题目内容
实验探究:探究碳、硅元素的非金属性的相对强弱.根据要求完成下列各小题.
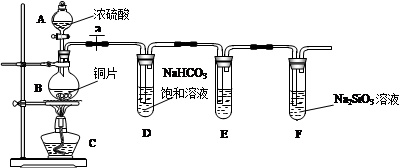
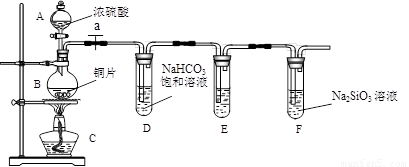
(1)实验装置:
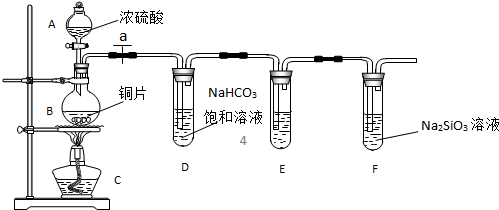
填写所示仪器名称A
(2)实验步骤:
连接仪器、
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性
(1)实验装置:

填写所示仪器名称A
分液漏斗
分液漏斗
B圆底烧瓶
圆底烧瓶
(2)实验步骤:
连接仪器、
检查装置的气密性
检查装置的气密性
、加药品后,打开a、然后滴入浓硫酸,加热.(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
;装置E中足量酸性KMnO4溶液(具有强氧化性)的作用是
| ||
除去SO2气体
除去SO2气体
;②能说明碳元素的非金属性比硅元素非金属性强的实验现象是
盛有Na2SiO3溶液的试管中出现白色沉淀
盛有Na2SiO3溶液的试管中出现白色沉淀
;③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性
否
否
(填“能”或“否”),试管D中发生反应的离子方程式是SO2+2HCO3-=SO32-+H2O+CO2
SO2+2HCO3-=SO32-+H2O+CO2
.分析:(1)根据装置图中的仪器分析;
(2)反应生成气体,在加入药品之前需要检验装置的气密性;
(3)①在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,据此写出反应方程式;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强;
③依据最高价含氧酸的酸性强弱判断非金属性强弱.
(2)反应生成气体,在加入药品之前需要检验装置的气密性;
(3)①在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,据此写出反应方程式;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强;
③依据最高价含氧酸的酸性强弱判断非金属性强弱.
解答:解:(1)根据装置图中的仪器可知A为分液漏斗,B为圆底烧瓶,
故答案为:分液漏斗;圆底烧瓶;
(2)反应生成气体,在加入药品之前需要检验装置的气密性,防止气密性不好导致气体泄漏,
故答案为:检查装置的气密性;
(3)①在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,其反应方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;除去SO2气体;
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,所以盛有Na2SiO3溶液的试管中出现白色沉淀即说明碳元素的非金属性比硅元素非金属性强,
故答案为:盛有Na2SiO3溶液的试管中出现白色沉淀;
③依据最高价含氧酸的酸性强弱判断非金属性强弱,二氧化硫溶于水生成的是亚硫酸,不是最高价含氧酸,所以不能判断非金属性强弱,试管D中发生反应是二氧化硫与碳酸氢钠生成二氧化碳,其离子方程式为:SO2+2HCO3-=SO32-+H2O+CO2,
故答案为:否;SO2+2HCO3-=SO32-+H2O+CO2.
故答案为:分液漏斗;圆底烧瓶;
(2)反应生成气体,在加入药品之前需要检验装置的气密性,防止气密性不好导致气体泄漏,
故答案为:检查装置的气密性;
(3)①在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,其反应方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
②二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,所以盛有Na2SiO3溶液的试管中出现白色沉淀即说明碳元素的非金属性比硅元素非金属性强,
故答案为:盛有Na2SiO3溶液的试管中出现白色沉淀;
③依据最高价含氧酸的酸性强弱判断非金属性强弱,二氧化硫溶于水生成的是亚硫酸,不是最高价含氧酸,所以不能判断非金属性强弱,试管D中发生反应是二氧化硫与碳酸氢钠生成二氧化碳,其离子方程式为:SO2+2HCO3-=SO32-+H2O+CO2,
故答案为:否;SO2+2HCO3-=SO32-+H2O+CO2.
点评:本题考查了非金属性的相对强弱的探究实验,涉及仪器名称,化学方程式的书写,离子方程式的书写,判断非金属性强弱的依据等 考查的知识点较多,难度中等.

练习册系列答案
相关题目