题目内容
(13分)实验探究:探究碳、硅元素的非金属性的相对强弱,根据要求完成下列各小题
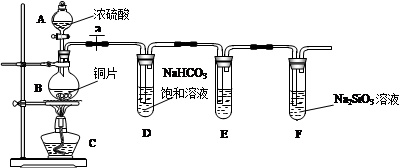
(1)实验装置:
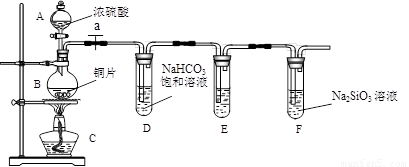
填写所示仪器名称A B
(2)实验步骤:
连接仪器、_____________、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是 ;
装置E中足量酸性KMnO4溶液的作用是 ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填“能”或“否”),试管D中发生反应的离子方程式是 。
(1)A:分液漏斗B:圆底烧瓶(每空1分)
(2)检查装置的气密性(2分)
(3)①Cu+2H2SO4(浓)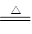 CuSO4+ SO2↑+2H2O
(2分)
除去SO2气体(2分)
CuSO4+ SO2↑+2H2O
(2分)
除去SO2气体(2分)
②盛有Na2SiO3溶液的试管中出现白色沉淀(2分)
③否(1分)SO2+2HCO3-=SO32-+ H2O+CO2↑或SO2+HCO3-=HSO3-+CO2↑(2分)
【解析】
(1)根据仪器的结构特点可判断,A是分液漏斗,B是圆底烧瓶。
(2)反应装置图连接后之后,第一步需要做的就是检验装置的气密性。
(3)浓硫酸具有强氧化性,在加热条件下和铜反应生成硫酸铜,SO2和水,方程式为Cu+2H2SO4(浓)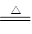 CuSO4+ SO2↑+2H2O。根据实验目的可知要验证碳和硅的非金属性强弱,可以利用较强的酸来制取较弱的酸来实现。所以首先利用SO2来制取碳酸,碳酸不稳定,放出CO2,CO2通入硅酸钠溶液中,可以生成白色沉淀。但为了防止SO2对CO2的干扰,必须对生成的CO2进行除杂。所以酸性高锰酸钾溶液是用来除去CO2中的SO2的。
CuSO4+ SO2↑+2H2O。根据实验目的可知要验证碳和硅的非金属性强弱,可以利用较强的酸来制取较弱的酸来实现。所以首先利用SO2来制取碳酸,碳酸不稳定,放出CO2,CO2通入硅酸钠溶液中,可以生成白色沉淀。但为了防止SO2对CO2的干扰,必须对生成的CO2进行除杂。所以酸性高锰酸钾溶液是用来除去CO2中的SO2的。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案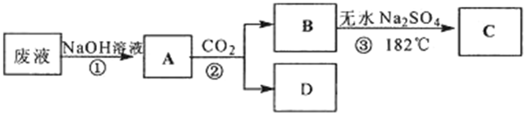
 +CO2+H2O→
+CO2+H2O→ +NaHCO3;
+NaHCO3;
 o
o
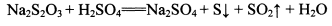
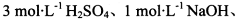 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
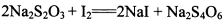 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得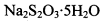 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。