题目内容
下列实验方案中不能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
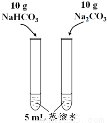
已知溶解度(20℃) NaHCO3:9.6 g Na2CO3:21.8 g |
将NO2球浸泡在冷水和热水中 |
目的 | 探究浓度对化学 反应速率的影响 | 制备氨气 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。

(1)用离子方程式解释现象I中出现胶状沉淀的原因: 。
(2)II中加碱时出现的现象是 ,此现象说明溶液中发生反应的离子方程式是 。
(3)III中加碱时出现的现象是 。
(4)用离子方程式解释IV中加碱时出现的现象: 。
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验。
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
1.0 mL | 0.1 mol·L?1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol·L?1 H2SO4溶液; 再滴加1.0 mL 0.5 mol·L?1 NaOH溶液 | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:向1.0 mL 0.1 mol·L?1 Fe(NO3)2溶液中 ,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应。
② 推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1 mol·L?1 Fe(NO3)2溶液中的Fe2+被NO3-氧化;
b. (用离子方程式表示)。
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
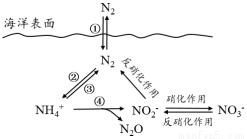
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是 (填字母序号)。
a. 海洋中的氮循环起始于氮的氧化
b. 海洋中存在游离态的氮
c. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
d. 海洋中的反硝化作用一定有氧气的参与
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将离子方程式补充完整:
 NH4++5O2
NH4++5O2 2NO2-+
2NO2-+ H++
H++ +
+
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg | 处理24 h | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是 ,在最佳反应温度时,48 h内去除氨氮反应的平均速率是 mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。如图是间接氧化工业废水中氨氮(NH4+)的示意图。
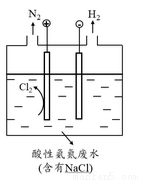
结合电极反应式简述间接氧化法去除氨氮的原理: 。
若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将 (填“增大”、“不变”或“减小”),请简述理由: 。





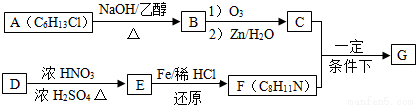
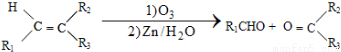
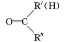

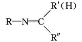 +H2O
+H2O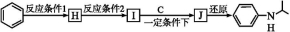



 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75 NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75 NA