题目内容
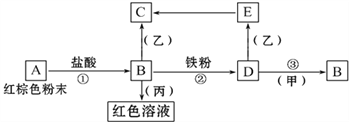
【题目】X、Y、Z均为短周期元素,原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1︰1的离子化合物A,X与Z能形成原子个数比为1︰1的共价化合物B,它们之间转化关系如图(部分产物已略去):
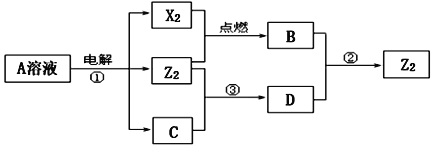
(1)Y在周期表的位置是_____,C的电子式是_____。
(2)反应①的化学方程式为_____。
(3)D溶液呈碱性的原因是(用离子方程式表示)_____。
(4)反应②的离子方程式为_____。
(5)工业上常将C溶液置于铁锅内直接加热得到固体C,此过程中会生成氢氧化亚铁等杂质,可加入硝酸钠使氢氧化亚铁氧化,然后脱水变成氧化铁沉降得到较纯的固体C。写出加入硝酸钠除杂的化学方程式_____。
【答案】第三周期第IA族 ![]() 2 NaCl+2H2O
2 NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ ClO—+ H2O
2NaOH+Cl2↑+H2↑ ClO—+ H2O ![]() HClO +OH— ClO—+Cl—+2H+ =Cl2↑+ H2O 10Fe(OH)2+2NaNO3+6H2O=10Fe(OH)3+2NaOH+N2↑、2Fe(OH)3=Fe2O3↓+3H2O
HClO +OH— ClO—+Cl—+2H+ =Cl2↑+ H2O 10Fe(OH)2+2NaNO3+6H2O=10Fe(OH)3+2NaOH+N2↑、2Fe(OH)3=Fe2O3↓+3H2O
【解析】
短周期元素X、Y、Z的原子序数依次增大,Y与Z能形成离子个数比为1:1的离子化合物A,电解A溶液可得X2、Z2单质及C,有三种物质生成,其中两种单质为双原子分子,应为电解水与电解质型的电解,则A为盐溶液,该盐溶液盐的阳离子不能放电,酸根离子放电,则A为NaCl,Y为Na,Z为Cl,故X2为H2、Z2为Cl2、C为NaOH.X和Y同主族,X与Z能形成原子个数比为1:1的共价化合物为HCl,H2与Cl2反应生成B为HCl,氯气能与氢氧化钠反应生成D为NaClO,NaClO能与HCl反应生成氯气。
(1)Y为钠元素,原子核外有3个电子层,最外层有1个电子,处于周期表第三周期第IA族;C为NaOH,电子式为![]() ;
;
(2)反应①为电解氯化钠溶液,生成氢气、氯气与氢氧化钠,反应方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;
2NaOH+Cl2↑+H2↑;
(3)D为NaClO,为强碱弱酸盐,溶液中ClO-水解:ClO-+H2OHClO+OH-,溶液呈碱性;
(4)反应②是盐酸与次氯酸钠反应,生成氯化钠、氯气与水,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O;
(5)工业上常将NaOH溶液置于铁锅内直接加热得到固体NaOH,此过程中会生成氢氧化亚铁等杂质,可加入硝酸钠使氢氧化亚铁氧化,然后脱水变成氧化铁沉降得到较纯的固体NaOH.加入硝酸钠除杂的化学方程式:10Fe(OH)2+2NaNO3+6H2O=10Fe(OH)3+2NaOH+N2↑、2Fe(OH)3=Fe2O3+3H2O。

 阅读快车系列答案
阅读快车系列答案