题目内容
在一个2 L的密闭容器中,加入3 mol A和1 mol B,发生下述反应:
3A(g)+B(g)??2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
(1)达到平衡时,A的转化率为 ,此温度下的平衡常数K= 。
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向 (填“正反应方向移动”“逆反应方向移动”或“不移动”)。
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比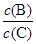 将 (填“增大”、“减小”或“不变”)。
将 (填“增大”、“减小”或“不变”)。
(4)当增加A的浓度,B的转化率 ;若将C分离出来,化学平衡常数 。(填“增大”、“减小”或“不变”)
3A(g)+B(g)??2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
(1)达到平衡时,A的转化率为 ,此温度下的平衡常数K= 。
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向 (填“正反应方向移动”“逆反应方向移动”或“不移动”)。
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比
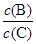 将 (填“增大”、“减小”或“不变”)。
将 (填“增大”、“减小”或“不变”)。(4)当增加A的浓度,B的转化率 ;若将C分离出来,化学平衡常数 。(填“增大”、“减小”或“不变”)
(1)60% 8.33 (2)正反应方向移动 (3)不变 (4)增大 不变
(1)根据各物质的速率之比等于化学计量数之比,也等于各物质的物质的量及浓度变化之比的原则进行“三段法”计算。
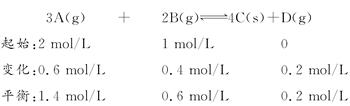
(2)温度不变而缩小容器体积,相当于加压,由于D为固体,正反应方向是气体体积减少的方向,所以平衡右移。
(3)由于维持体系的温度、容积不变,充入氦气不改变平衡中各物质的浓度,平衡不移动。
(4)若增加A的浓度,平衡右移,B的转化率增大;对于一个平衡来讲,平衡常数仅与温度有关,与浓度无关。
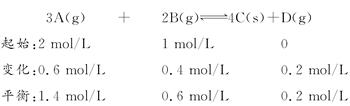
(2)温度不变而缩小容器体积,相当于加压,由于D为固体,正反应方向是气体体积减少的方向,所以平衡右移。
(3)由于维持体系的温度、容积不变,充入氦气不改变平衡中各物质的浓度,平衡不移动。
(4)若增加A的浓度,平衡右移,B的转化率增大;对于一个平衡来讲,平衡常数仅与温度有关,与浓度无关。

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ( )
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ( ) I(aq)的ΔH>0
I(aq)的ΔH>0
 2SO3至平衡。
2SO3至平衡。 SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )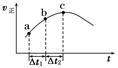
 CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
 pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( ) SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。