题目内容
含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物.回答下列问题:
(1)写出硫元素在周期表中位置 .
(2)Ba2+有剧毒.某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒.试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式 .
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应.为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化.
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2.该反应的化学方程式: .
(1)写出硫元素在周期表中位置
(2)Ba2+有剧毒.某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒.试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应.为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2.该反应的化学方程式:
考点:含硫物质的性质及综合应用
专题:氧族元素
分析:(1)硫元素属于第16号元素;
(2)碳酸钡与盐酸反应生成氯化钡、二氧化碳与水;
(3)钝化是在金属表面生成一层致密的氧化物保护膜,阻止内部进行进行反应,若发生钝化,则氧化物保护膜阻止Fe与硫酸铜反应;
(4)用CO还原SO2得到单质硫,根据电子转移守恒可知,碳元素被氧化生成二氧化碳.
(2)碳酸钡与盐酸反应生成氯化钡、二氧化碳与水;
(3)钝化是在金属表面生成一层致密的氧化物保护膜,阻止内部进行进行反应,若发生钝化,则氧化物保护膜阻止Fe与硫酸铜反应;
(4)用CO还原SO2得到单质硫,根据电子转移守恒可知,碳元素被氧化生成二氧化碳.
解答:
解:(1)硫元素属于第16号元素在周期表中位置为:第三周期,第VIA族;
故答案为:第三周期,第VIA族;
(2)碳酸钡与盐酸反应生成氯化钡、二氧化碳与水,奇反应的离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O;
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)钝化是在金属表面生成一层致密的氧化物保护膜,阻止内部进行进行反应,若发生钝化,则氧化物保护膜阻止Fe与硫酸铜反应,无明显现象;
故答案为:无明显现象;
(4)用CO还原SO2得到单质硫,根据电子转移守恒可知,碳元素被氧化生成二氧化碳,反应方程式为:SO2+2CO
S+2CO2,
故答案为:SO2+2CO
S+2CO2.
故答案为:第三周期,第VIA族;
(2)碳酸钡与盐酸反应生成氯化钡、二氧化碳与水,奇反应的离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O;
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)钝化是在金属表面生成一层致密的氧化物保护膜,阻止内部进行进行反应,若发生钝化,则氧化物保护膜阻止Fe与硫酸铜反应,无明显现象;
故答案为:无明显现象;
(4)用CO还原SO2得到单质硫,根据电子转移守恒可知,碳元素被氧化生成二氧化碳,反应方程式为:SO2+2CO
| 一定条件 |
故答案为:SO2+2CO
| 一定条件 |
点评:本题主要考查了离子方程式的书写、元素化合物的性质等,难度中等,掌握元素化合物的性质是解题的关键,侧重于考查学生分析问题和解决问题的能力.

练习册系列答案
相关题目
将一定量铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体的体积为4.48L(标准状况下),则原溶液中硝酸的浓度为( )
| A、1.0mol?L-1 |
| B、0.8mol?L-1 |
| C、0.6mol?L-1 |
| D、0.4mol?L-1 |
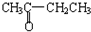
 与
与
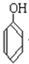 与
与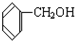
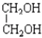 与
与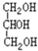
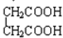 与
与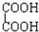
 铊的相关信息卡片如图所示:
铊的相关信息卡片如图所示: 某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得: