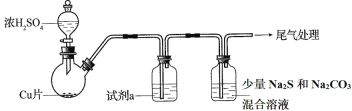
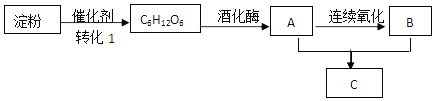
题目内容
【题目】CO2催化加氢制取甲醇、乙醇等低碳醇的研究,对于环境问题和能源问题都具有非常重要的意义。已知一定条件下的如下反应:
CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) H =-49.0 kJ· mol-1
CH3OH(g) + H2O(g) H =-49.0 kJ· mol-1
2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g) H=-173.6 kJ· mol-1
CH3CH2OH(g) + 3H2O(g) H=-173.6 kJ· mol-1
下列说法不正确的是
A.CH3OH(g) + CO2(g) + 3H2(g) ![]() CH3CH2OH(g) + 2H2O(g) H<0
CH3CH2OH(g) + 2H2O(g) H<0
B.增大压强,有利于反应向生成低碳醇的方向移动,平衡常数增大
C.升高温度,可以加快生成低碳醇的速率,但反应限度降低
D.增大氢气浓度可以提高二氧化碳的转化率
【答案】B
【解析】
A.根据盖斯定律,用第二个反应减第一个反应得:![]() ,故A正确;
,故A正确;
B.温度不变,平衡常数不变,故B错误;
C.升高温度,正逆反应速率都可以加快,升高温度,平衡向吸热反应方向进行,即平衡逆向移动,反应限度降低,故C正确;
D.反应物中氢气和二氧化碳都是气体,增大一种反应物的浓度可以提高另一种反应物的转化率,故D正确;
故选:B。

 名校课堂系列答案
名校课堂系列答案【题目】(1)某学生用标准盐酸滴定待测的NaOH溶液,根据3次实验分别记录有关数据如表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
则依据表中数据,该NaOH溶液的物质的量浓度为______。
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作可能使测定结果偏低的是______。
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00mL酸性高锰酸钾溶液应用______。(填仪器名称)