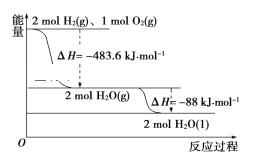
题目内容
【题目】25℃时,下列有关电解质溶液说法正确的是
A. 1. 0mol/L NH4HCO3溶液pH=8.0,由此可知Ka1(H2CO3)>Kb (NH3·H2O)>Kaa2(H2 CO3)
B. 向氨水中加入NH4C1固体,溶液中c(NH3·H2O )·c(H+)/c(NH4+)增大
C. 向CH3 COONa溶液中滴加硫酸至中性时,c(SO42-)<c(CH3COOH)
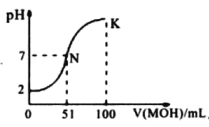
D. 图中曲线可以表示向100mL0.01mol/LCH3COOH溶液中逐滴加入0.02 mol/LNaOH溶液的pH变化情况(溶液体积变化忽略不计)
【答案】C
【解析】
A、1.0mol·L-1NH4HCO3溶液的pH=8.0,溶液显碱性,即HCO3-水解程度大于NH4+水解程度,根据Kh=Kw/Ka,HCO3-水解平衡常数为Kh=Kw/Ka1,NH4+水解平衡常数:Kh=Kw/Kb,则有Ka1<Kb,即Ka1(H2CO3)<Kb(NH3·H2O),故A错误;
B、![]() =
=![]() ,Kw和Kb只受温度的影响,向氨水中加入NH4Cl固体,温度不变,即Kw和Kh不变,该比值保持不变,故B错误;
,Kw和Kb只受温度的影响,向氨水中加入NH4Cl固体,温度不变,即Kw和Kh不变,该比值保持不变,故B错误;
C、电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)+2c(SO42-),溶液显中性,c(H+)=c(OH-),推出c(Na+)=c(CH3COO-)+2c(SO42-),依据物料守恒:c(CH3COOH)+c(CH3COO-)=c(Na+),两式合并得出:c(CH3COOH)=2c(SO42-),因此有c(SO42-)<c(CH3COOH),故C正确;
D、CH3COOH为弱酸,0.01mol·L-1CH3COOH溶液的pH>2,故D错误。

【题目】下列试管中,不同条件下反应:Fe+2HCl=FeCl2+H2↑,判断产生H2的反应速率最小的是
试管 | 盐酸浓度 | 温度 | 铁的状态 |
A | 0.5 mol/L | 20 ℃ | 块状 |
B | 0.5 mol/L | 20 ℃ | 粉末状 |
C | 2 mol/L | 35 ℃ | 粉末状 |
D | 1 mol/L | 35 ℃ | 块状 |
A. AB. BC. CD. D