题目内容
(12)用A、B、C三种装置都可制取溴苯。请仔细分析三套装置,然后回答下列问题。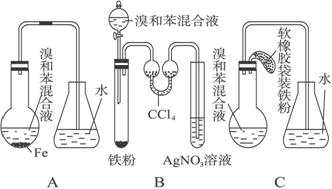
(1)写出三个装置中都发生的化学反应方程式_____________、_____________;写出B的试管中还发生的化学反应方程式_____________。
(2)装置A、C中长导管的作用是________。
(3)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对B应进行的操作是__________,对C应进行的操作是_______________。
(4)A中存在加装药品和及时密封的矛盾,因而在实验中易造成的不良后果是______。
(5)B中采用了双球吸收管,其作用是______________;反应后双球管中可能出现的现象_______________;双球管内液体不能太多,原因是_________________________。
(6)B装置也存在两个明显的缺点使实验效果不好或不能正常进行。这两个缺点是________________________、________________________。
(1)2Fe+3Br2=2FeBr3 
HBr+AgNO3=AgBr↓+HNO3
(2)导气(导出HBr)兼冷凝(冷凝 和Br2蒸气)
和Br2蒸气)
(3)旋转分液漏斗活塞,使Br2和苯的混合物滴到铁粉上;托起软橡胶袋使Fe粉沿导管落入溴和苯组成的混合液中
(4)Br2和苯的蒸气逸出,污染环境
(5)吸收反应中随HBr气体逸出的Br2和苯蒸气;CCl4由无色变橙色;易被气体压入试管中
(6)随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低 导管插入AgNO3溶液中易产生倒吸
解析

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
 ( 12分)A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去)。
( 12分)A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去)。