题目内容
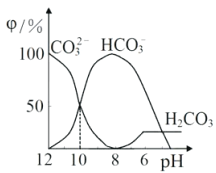
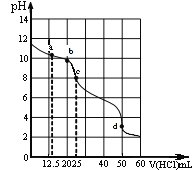
【题目】乙二胺(H2NCH2CH2NH2)是二元弱碱,在水中的电离原理类似于氨。常温下,向乙二胺溶液中滴加稀盐酸,溶液的pH随离子浓度变化关系如图所示。下列叙述不正确的是( )
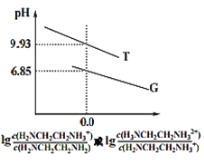
A.Kb2[H2NCH2CH2NH2]的数量级为10-8
B.曲线G代表pH与lg![]() 的变化关系
的变化关系
C.H3NCH2CH2NH2Cl溶液中c(H+)>c(OH-)
D.0.01mol·L-1H2NCH2CH2NH2电离度约为10%
【答案】C
【解析】
多元弱碱的第一级电离大于第二级电离,故曲线T代表pH与lg![]() 的变化关系,曲线G代表pH与lg
的变化关系,曲线G代表pH与lg![]() 的变化关系,由曲线所示关系和电离平衡常数相关知识分析可得结论。
的变化关系,由曲线所示关系和电离平衡常数相关知识分析可得结论。
A.Kb2[H2NCH2CH2NH2]=![]() ,当lg
,当lg![]() =0时,即
=0时,即![]() =
=![]() ,Kb2[H2NCH2CH2NH2]=
,Kb2[H2NCH2CH2NH2]=![]() =10-7.15,故A正确;
=10-7.15,故A正确;
B.根据分析,因多元弱碱的第一级电离大于第二级电离,曲线G代表pH与lg![]() 的变化关系,故B正确;
的变化关系,故B正确;
C.在H3NCH2CH2NH2Cl溶液中,既有H2NCH2CH2NH3的电离,又有H2NCH2CH2NH3+的水解,由图中T曲线可得H2NCH2CH2NH3+的水解平衡常数Kh=c(H+)=10-9.93,而Kb2[H2NCH2CH2NH2]= 10-7.15,由此可知在H3NCH2CH2CH2NH3+的电离大于水解,溶液显碱性,故C错误;
D.设0.01molL-1H2NCH2CH2NH2电离度为a,则有Kb1[H2NCH2CH2NH2]=![]() =10-4.07,解得a=0.1,故D正确;
=10-4.07,解得a=0.1,故D正确;
答案选C。

练习册系列答案
相关题目