题目内容
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:

①三种元素电负性大小关系为________.
②写出Y原子的电子排布式________Y的第一电离能大于Z的第一电离能的原因________.
③X晶体采用下列________(填字母) 堆积方式.

(2)N2O的等电子体为:①分子________,②阴离子________;由此可知N2O的中心原子的杂化类型为________.根据价层电子对互斥模型确定NO2的分子构型为:________.
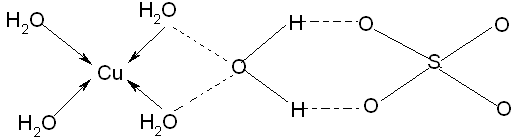
(3)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,

请在图中标出水合铜离子中的配位键.
答案:
解析:
解析:
|
(1)①Z>Y>X ②1s22s22p63s2 Y元素原子最外层s轨道上的电子为全满 ③A (2)①CO2 ②SCN-或N3- SP V型 (3)
|

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
已知X,Y、Z、W都是短周期主族元素,它们的原子半径和化合价等性质如下表所示.
|
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,
请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为 ;
(2)冰比硫化氢熔点高的原因是 ,冰分子中氧原子的杂化轨道
类型为 ;水的密度在4℃最大的原因是 ;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
元素Y第一电离能大于X的原因是 ;
(4)已知CN-与 N2结构相似,1mol CN-中π键数目为 .
请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为
(2)冰比硫化氢熔点高的原因是
类型为
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(4)已知CN-与 N2结构相似,1mol CN-中π键数目为
 已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子价电子排布式为ns1,Y元素是空气中含量最多的元素,Z 与W同主族,而且W原子的电子排布式中,p轨道上只有1个未成对电子.
已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子价电子排布式为ns1,Y元素是空气中含量最多的元素,Z 与W同主族,而且W原子的电子排布式中,p轨道上只有1个未成对电子.

