题目内容
(11分)Ⅰ.“中东有石油,中国有稀土”。稀土金属是我国战略性资源,应加以保护。稀土金属是周期表中ⅢB族中钪、钇和镧系十七种元素的总称,都是很活泼的金属,性质极为相似,常见化合价为+3价。钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下: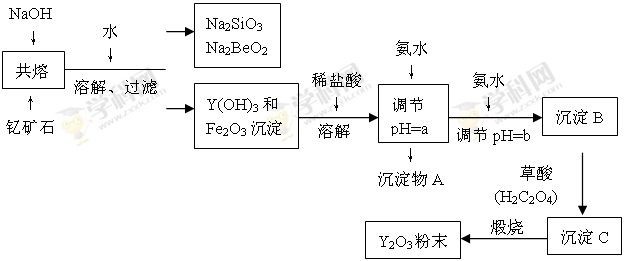
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则最好选用盐酸和 (填字母)
两种试剂,通过必要的操作即可实现。
A.NaOH溶液 B、氨水 C、CO2 D、HNO3
(2)流程图中用氨水调节pH=a时生成沉淀的化学式为 ,继续加氨水调至pH=b,此时发生反应的离子方程式为 。
(3)沉淀C为草酸钇,写出草酸钇隔绝空气加热生成Y2O3的化学方程式: 。
Ⅱ镧系元素铈(Ce)是地壳中含量最高的稀土元素,在加热的条件下CeCl3易发生水解。
(4)无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备,其中NH4Cl的作用是___
。
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过反应形成Ce(OH)4沉淀得以分离, 写出反应的离子方程式 。
(11分)(1)B (1分)
(2)Fe(OH)3 (1分)、Y3++3NH3·H2O=Y(OH)3↓+3NH4+ (2分)
(3)Y2(C2O4)3 Y2O3+3CO2↑+ 3CO↑ (3分)
Y2O3+3CO2↑+ 3CO↑ (3分)
(4)NH4Cl固体受热分解产生HCl,抑制CeCl3水解(2分)
(5)2Ce3++H2O2+6H2O=2Ce(OH)4↓+ 6H+ (2分)
解析试题分析:(1)周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,则根据Na2BeO2的性质和NaAlO2类比推断;加过量的盐酸,硅酸钠反应生成硅酸沉淀,Na2BeO2的反应生成氯化铍溶液,再加入过量氨水沉淀铍离子,故答案为:B。
(2)根据流程图可知,沉淀物A应该是氢氧化铁,所以流程图中用氨水调节pH=a时生成沉淀的化学式为Fe(OH)3;根据有关金属离子形成氢氧化物沉淀时的pH可知,继续加氨水调至pH=b,此时生成分沉淀应该是Y(OH)3,则发生反应的离子方程式为Y3++3NH3·H2O=Y(OH)3↓+3NH4+。
(3)沉淀C为草酸钇,根据原子守恒可知,草酸钇隔绝空气加热生成Y2O3的同时,还有CO和CO2生成,所以分解的化学方程式为Y2(C2O4)3 Y2O3+3CO2↑+ 3CO↑。
Y2O3+3CO2↑+ 3CO↑。
(4)在加热的条件下CeCl3易发生水解生成氯化氢和Ce(OH)3,因此在加热时必须防止其水解。由于NH4Cl固体受热分解产生HCl,HCl可以抑制CeCl3水解。
(5)H2O2具有强氧化性,在溶液中通过调节pH≈3,可以将Ce3+氧化形成Ce(OH)4沉淀,其中Ce元素的化合价从+3价升高到+4价,失去1个电子。双氧水中氧元素的化合价从-1价降低到-2价,则根据电子得失守恒和原子守恒可知反应的离子方程式为2Ce3++H2O2+6H2O=2Ce(OH)4↓+6H+。
考点:考查元素化合物性质的类比推断,物质分离,水解应用以及氧化还原反应方程式的书写等

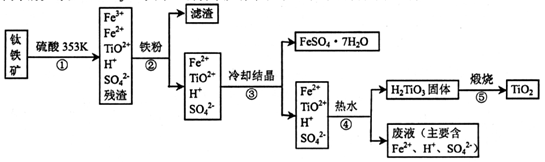
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业。工业上利用TiO2制备金属钛的流程如下。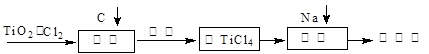
已知:I.
Ti(s)+O2(g)=TiO2(s) △H=-946 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
Ti(s)+2Cl2(g)=TiCl4(g) △H=-815 kJ·mol-1
II.某温度下各物质的沸点如下:
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
回答下列问题:
(1)在氯化工序中发生反应:TiO2(s)+2Cl2(g)+2C(s)
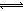 TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
(2)氯化过程中带入的副产物有FeCl3、SiCl4和AlCl3,可用 方法获得较纯净的TiCl4。
(3)TiO2与Cl2反应:TiO2(s)+2Cl2(g)
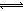 TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因 (4)还原工序要在惰性气体的气氛中进行的理由是_______________________。
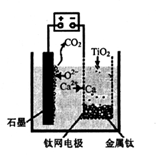
(5)制取Ti的新工艺是用二氧化钛作阴极,以石墨为阳极,以CaCl2熔盐做电解质(在熔融状态下能传导O2-),电解而得到Ti,该工艺具有操作简单,成本低,无污染等优点,写出电解制备金属钛时阴极的电极反应式: 。
用硫铁矿做原料,用接触法生产硫酸的过程中,对废弃资源的处理不正确的是 ( )。
| A.氨—酸法尾气脱硫是先将尾气用氨水吸收,然后再用浓硫酸处理 |
| B.与尾气脱硫技术相比,两转两吸流程投资较少,但运行费用相对较高 |
| C.可以从制硫酸排出的烧渣中回收铁、有色金属以及贵重金属金和银 |
| D.沸腾炉旁可以设置“废热”锅炉,利用余热产生的蒸汽来发电或供热 |
 发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。