题目内容
11.一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法不正确的是( )
| A. | 中间室Cl-移向左室 | |
| B. | X气体为CO2 | |
| C. | 处理后的含硝酸根废水pH降低 | |
| D. | 电路中每通过4 mol电子,产生标准状况下X的体积为22.4L |
分析 该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极是负极,负极上有机物失电子发生氧化反应生成X,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,有机物在厌氧菌作用下生成二氧化碳,据此分析解答.
解答 解:该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极是负极,负极上有机物失电子发生氧化反应生成X,有机物在厌氧菌作用下生成二氧化碳,
A.放电时,电解质溶液中阴离子Cl-移向负极室左室,故A正确;
B.有机物在厌氧菌作用下生成二氧化碳,所以X气体为CO2,故B正确;
C.正极电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,氢离子参加反应导致溶液酸性减小,溶液的pH增大,故C错误;
D.根据负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+知,电路中每通过4mol电子,产生标准状况下X的体积为=$\frac{4}{24}$×6×22.4=22.4L,故D正确;
故选C.
点评 本题考查化学电源新型电池,侧重考查学生获取信息、分析推断能力,根据N元素化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握.

练习册系列答案
相关题目
1.下列溶液中溶质物质的量浓度为0.1mol•L-1的是( )
| A. | 将4.0gNaOH溶解于1L水中配成NaOH溶液 | |
| B. | 将6.2gNa2O溶于水并配成2L溶液 | |
| C. | 将0.5mol•L-1NaNO3溶液100mL加热蒸发掉50g水后的溶液 | |
| D. | 1L含K+为0.1mol的K2SO4溶液 |
2.分子式为C10H14的可能结构中只有一个取代基且含有苯环的结构共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
19.化学是你,化学是我.下列有关说法错误的是( )
| A. | PVC保鲜膜属于链状聚合物,在加热时易熔化,能溶于氯仿 | |
| B. | 汽车尾气排放的NO2等气体是造成光化学污染的主要原因 | |
| C. | 焰色反应是金素元素的性质,属于化学变化 | |
| D. | 误食含有大量Cu2+的食物可以服用鲜牛奶解毒 |
6.在标准状况下,将1molH2和11.2LO2混合,得到气体的体积为( )
| A. | 12.2 L | B. | <22.4 L | C. | 33.6 L | D. | 无法确定 |
16.下列说法中正确的是( )
| A. | 10 L 0.05mol•L-1Ba(OH)2溶液与10 L 0.05mol•L-1 H2SO4反应时的反应热是中和热 | |
| B. | 由2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1知,该反应的反应热为571.6 kJ•mol-1 | |
| C. | 由2H2(l)+O2(l)=2H2O(g)△H=-482.6 kJ•mol-1知,H2的燃烧热为482.6 kJ•mol-1 | |
| D. | 由C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5 kJ•mol-1知,气体C3H8的燃烧热为2221.5 kJ•mol-1 |
20.下列说法正确的是( )
| 元素 | 有关信息 |
| X | 所在主族序数与所在周期序数之差为4,在该周期中原子半径最小 |
| Y | 在最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| Z | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| W | 地壳中含量最高的金属元素 |
| A. | W与Y的最高价氧化物对应的水化物之间可相互反应 | |
| B. | 原子半径的大小顺序为:rX>rY>rW | |
| C. | 向浓ZX3溶液中滴加少量的Na2SO3溶液,可产生大量沉淀和气体 | |
| D. | 可用电解W与X形成的化合物来制取W单质 |
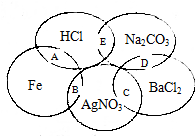 如图图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:
如图图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题: