��Ŀ����
����Ŀ����12�֣�����Ӧ�ù㷺�Ľ���������������Ҫ�ɷ�ΪAl2O3 �� ��SiO2��Fe2O3�����ʣ�Ϊԭ���Ʊ�����һ�ֹ����������£�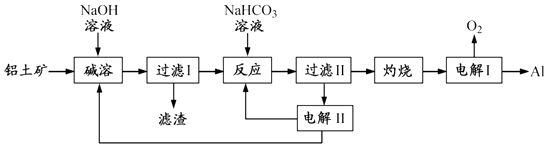
ע��SiO2�ڡ����ܡ�ʱת��Ϊ�������Ƴ�����
��1�������ܡ�ʱ����ƫ�����Ƶ����ӷ���ʽΪ ��
��2�����ˢ�������Һ�м���NaHCO3��Һ����Һ��pH ������������䡱��С������
��3���������ǵ������ Al2O3 �� ����������������ʯī�����ģ�ԭ���� ��
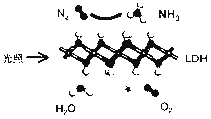
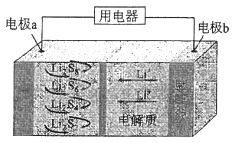
��4���������ǵ��Na2CO3��Һ��ԭ����ͼ��ʾ��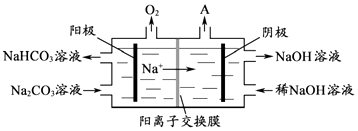
�����ĵ缫��ӦʽΪ �� ��������������A�Ļ�ѧʽΪ ��
��5��������1000��ʱ����N2��Ӧ�Ʊ�AlN������������������NH4Cl���岢��ֻ�ϣ�������AlN���Ʊ�������Ҫԭ���� ��
���𰸡�
��1��Al2O3+2OH���T2AlO2��+H2O
��2����С
��3��ʯī�缫�������ϲ�����O2����
��4��4CO32��+2H2O��4e���T4HCO3��+O2����H2
��5��NH4Cl�ֽ������HCl�ܹ��ƻ�Al�����Al2O3��Ĥ
����������:��1�������ܡ�ʱ����ƫ�����Ƶ����ӷ���ʽΪAl2O3+2OH���T2AlO2��+H2O�����Դ��ǣ�Al2O3+2OH���T2AlO2��+H2O����2�����ˢ�������Һ�м���NaHCO3��Һ����NaAlO2��Ӧ������������������̼���ƣ�����ΪOH����AlO2����CO32�� �� ��֪��Һ��pH��С�����Դ��ǣ���С����3���������ǵ������ Al2O3 �� ����������������ʯī�����ģ���ʯī�缫�������ϲ�����O2������
���Դ��ǣ�ʯī�缫�������ϲ�����O2��������4����ͼ��֪��������ӦΪ4CO32��+2H2O��4e���T4HCO3��+O2���������������ӵõ�������������������������������A�Ļ�ѧʽΪH2 ��
���Դ��ǣ�4CO32��+2H2O��4e���T4HCO3��+O2����H2�� ��5��������1000��ʱ����N2��Ӧ�Ʊ�AlN������������������NH4Cl���岢��ֻ�ϣ�������AlN���Ʊ�������Ҫԭ����NH4Cl�ֽ������HCl�ܹ��ƻ�Al�����Al2O3��Ĥ�����Դ��ǣ�NH4Cl�ֽ������HCl�ܹ��ƻ�Al�����Al2O3��Ĥ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�