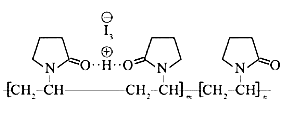
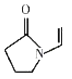
题目内容
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如下。下列说法不正确的是( )
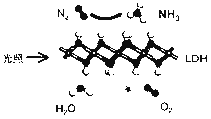
A. 该过程将太阳能转化成为化学能 B. 该过程中,涉及极性键与非极性键的断裂与生成
C. 氧化产物与还原产物的物质的量之比为3∶4 D. 该反应为放热反应
【答案】D
【解析】根据图示,该反应为N2和H2O在常温常压和可见光、LDH存在下反应生成NH3和O2。A项,该过程中将太阳能转化为化学能,A项正确;B项,反应物N2中存在非极性键、H2O中存在极性键,生成物NH3中存在极性键、O2中存在非极性键,化学反应的本质是旧化学键的断裂和新化学键的形成,该过程中涉及极性键与非极性键的断裂与生成,B项正确;C项,在该反应中氧化产物为O2,还原产物为NH3,根据得失电子守恒,4n(O2)=3n(NH3),n(O2):n(NH3)=3:4,C项正确;D项,该反应将太阳能转化为化学能,为吸热反应,D项错误;答案选D。

【题目】A同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体.但他在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体.
物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
[提出问题]为什么会生成淡黄色固体?
[查阅资料]该同学查阅资料,记录了右
表中几种物质的颜色:
(1)其他同学认为不必查阅氯化镁的颜色,理由是 ;
(2)[提出猜想]分析资料,A同学认为淡黄色固体可能是由镁与空气中的 反应生成的;
(3)[实验探究]该同学设计实验证实了自己的猜想,他的方案可能是 将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体 ;
(4)[实验结论]根据该同学的实验结果,写出镁条在空气中燃烧时发生的两个反应的化学方程式: 、 ;
(5)[反思与评价]通过上述实验,你对燃烧有什么新的认识? .
【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2S4 | H2O | ||
V/mL | c(molL﹣1) | V/mL | c(molL﹣1) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D