题目内容
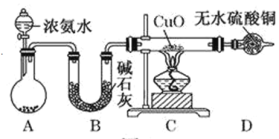
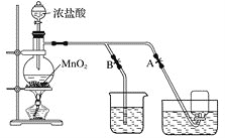
【题目】在如图用石墨作电极的电解池中,放入500mL含—种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题:
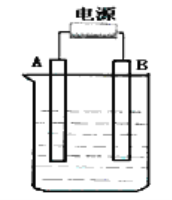
(1)写出电解时反应的总离子方程式____________________。
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重6g。电解后溶液的pH为_____________。要使电解后溶液恢复到电解前的状态,则需加入_____________,其质量为_____________g。(假设电解前后溶液的体积不变)
(3)若原溶液为1L K2SO4、CuSO4的混合溶液,且c (SO42-) =2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。则原溶液中的c(K+)=_____________。
【答案】2Cu2++2H2O![]() 2Cu+O2↑+4H+ pH=l CuO (或 CuCO3) 2 (或 3.1) c(K+) =2moI/L
2Cu+O2↑+4H+ pH=l CuO (或 CuCO3) 2 (或 3.1) c(K+) =2moI/L
【解析】
(1)根据实验现象判断A、B的电极名称,并写出电极反应式及电池反应式;
(2)根据电池反应式中铜与氢离子的关系式计算氢离子的物质的量,从而确定溶液的pH值;根据电池反应式电解出的物质判断并计算析出物质的质量;
(3)根据电解时阴阳极上得失电子守恒计算铜的物质的量,从而算出铜离子的浓度,根据溶液中阴阳离子的电荷守恒计算钾离子的浓度。
电解硫酸盐时,溶液中氢氧根离子放电能力大于硫酸根离子,所以在阳极上析出氧气,根据实验现象判断,在阴极上析出铜,所以B极是阳极;阳极上氢氧根离子失电子生成水和氧气,电极反应式为4OH--4e-=2H2O+O2↑;根据实验现象知,溶液中铜离子得电子变成铜单质析出,氢氧根离子失电子变成水和氧气,所以其电池反应式为2Cu2++2H2O![]() 2Cu+O2↑+4H+,
2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O![]() 2Cu+O2↑+4H+。
2Cu+O2↑+4H+。
(2)2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
128g 4mol
1.6g 0.05mol
c(H+)=0.05mol÷0.5L=0.1mol/L,故pH=1;
取出A电极,洗涤、干燥、称量、电极增重1.6g,这说明析出的铜质量是1.6g,物质的量是0.025mol,要使电解后溶液恢复到电解前的状态,则需加入CuO或CuCO3,其质量为0.025mol×80g/mol=2.0g或0.025mol×124g/mol=3.1g,
故答案为:pH=1;CuO或CuCO3;2或3.1。
(3)电解时阳极上析出氧气,阴极上析出氢气和铜,22.4L气体的物质的量为1mol,根据电解时阴阳极上得失电子守恒,列关系式为:n(H2)×2+n(Cu)×2=n(O2)×4,1mol×2+n(Cu)×2=1mol×4,n(Cu)=1mol,故c(Cu2+)=1mol/1mol/L,
根据溶液中阴阳离子的电荷守恒列关系式为:c(Cu2+)×2+c(K+)×1=c(SO42-)×2,所以c(K+)=2mol/L,
故答案为:2mol/L。

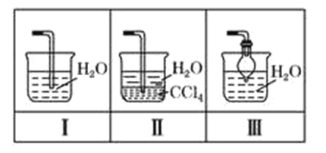
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 将溴乙烷和氢氧化钠的乙醇溶液共热后产生的气体通入溴的四氯化碳溶液,溶液褪色 | 溴乙烷发生消去反应 |
C |
|
|
D | 向 |
|
A.AB.BC.CD.D