题目内容
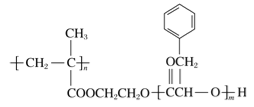
【题目】已知某有机物的结构简式为:![]() ,则该物质可能具有的化学性质为( )
,则该物质可能具有的化学性质为( )
①银镜反应 ②被新制的氢氧化铜氧化 ③1mol该有机物在一定条件下和2mol氢气发生加成反应 ④能使溴水褪色 ⑤能形成高聚物 ⑥被酸性KMnO4溶液氧化.
A. ①③④⑤ B. ②③④⑥ C. ①③⑤ D. ①②③④⑤⑥
【答案】D
【解析】①该有机物分子中含有醛基,能够发生银镜反应,故①正确;②含有官能团醛基,能够与新制的氢氧化铜氧化,故②正确;③1mol该有机物中含有1mol碳碳双键、1mol醛基,能够与2mol氢气发生加成反应,故③正确;④分子中含有碳碳双键和醛基,能够与溴水反应而使溴水褪色,故④正确;⑤含有官能团碳碳双键,能够发生加聚反应生成高分子化合物,故⑤正确;⑥含有碳碳双键和醛基,能够被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液褪色,故⑥正确;故选D。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为________.
(2)不同温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH1______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mol/L,则CO的平衡转化率为______。
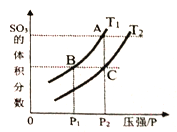
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1____T2 (填“>”或“<");理由是_____。如果想加快正反应的速率,除了改变温度,还可以用_______方法。
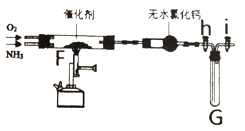
【题目】工业合成硝酸的基础是NH3的催化氧化,某实验小组实验室中对该反应进行了探究。回答下列问题:
(1)气体制备与净化
①实验室常采用装置甲制备干燥纯净的NH3,则制取NH3的化学方程式___________________,仪器B中选取的试剂是______________(名称)。

②该小组采用KClO3 MnO2制备纯净的O2,通过查阅资料,发现该方法制备的O2中含有Cl2杂质。图乙是该小组制备纯净O2时可能用到的装置。装置连接顺序为C![]() ______ (部分仪器可重复使用),其中除去Cl反应的化学方程式为_________。
______ (部分仪器可重复使用),其中除去Cl反应的化学方程式为_________。
(2)氨的催化氧化
打开图中活塞h和活塞i,将(1)中制备的纯净NH3、O2 (O2过量) 通入到F装置中,喷灯加热,观察现象。
操作步骤 | 实验现象 | 解释原因 |
待铂粉为红热状态,停止加热 | 铂粉持续红热,G试管内① _____________ | ②__________ |
关闭活塞h和活塞i,取下装置 G,将该装置置于冷水中 | G中试管内③__________ | ④__________ |
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D