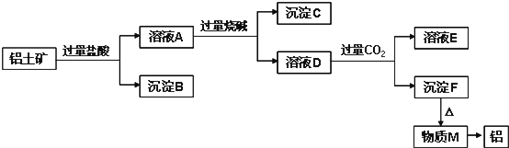
��Ŀ����
����Ŀ����ҵ�ϳ�����Ļ�����NH3�Ĵ�������ijʵ��С��ʵ�����жԸ÷�Ӧ������̽�����ش���������:
��1�������Ʊ��뾻��
��ʵ���ҳ�����װ�ü��Ʊ����﴿����NH3,����ȡNH3�Ļ�ѧ����ʽ___________________������B��ѡȡ���Լ���______________(����)��

�ڸ�С�����KClO3 MnO2�Ʊ�������O2,ͨ���������ϣ����ָ÷����Ʊ���O2�к���Cl2���ʡ�ͼ���Ǹ�С���Ʊ�����O2ʱ�����õ���װ�á�װ������˳��ΪC![]() ______ (�����������ظ�ʹ��)�����г�ȥCl��Ӧ�Ļ�ѧ����ʽΪ_________��
______ (�����������ظ�ʹ��)�����г�ȥCl��Ӧ�Ļ�ѧ����ʽΪ_________��
��2�����Ĵ�����
��ͼ�л���h�ͻ���i,��(1)���Ʊ��Ĵ���NH3��O2 (O2����) ͨ�뵽Fװ���У���Ƽ��ȣ��۲�����
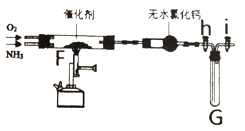
�������� | ʵ������ | ����ԭ�� |
������Ϊ����״̬��ֹͣ���� | ���۳������ȣ�G�Թ��ڢ� _____________ | ��__________ |
�رջ���h�ͻ���i��ȡ��װ�� G,����װ��������ˮ�� | G���Թ��ڢ�__________ | ��__________ |
���𰸡� 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O ��ʯ�� E
CaCl2+2NH3��+2H2O ��ʯ�� E![]() D
D![]() D(��D
D(��D![]() D) Cl2+2NaOH=NaCl+NaClO+H2O ��������ɫ���� ����������Ϊ���ȷ�Ӧ:���ɵ�NO��δ��Ӧ��O2��������NO2 ������ɫ��dz �¶Ƚ��ͣ�ƽ��2NO2
D) Cl2+2NaOH=NaCl+NaClO+H2O ��������ɫ���� ����������Ϊ���ȷ�Ӧ:���ɵ�NO��δ��Ӧ��O2��������NO2 ������ɫ��dz �¶Ƚ��ͣ�ƽ��2NO2![]() N2O4�����ƶ�������NO2ת��ΪN2O4
N2O4�����ƶ�������NO2ת��ΪN2O4
����������.��.ʵ���ҳ������Ȼ�粒������������ƹ��������ȡ��������Ӧ����ʽΪ��2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O����������ˮ�������ʣ����Կ��Բ��ü�ʯ�ҽ��и���ʴ��ǣ�2NH4Cl+Ca(OH)2
CaCl2+2NH3��+2H2O����������ˮ�������ʣ����Կ��Բ��ü�ʯ�ҽ��и���ʴ��ǣ�2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O����ʯ�ң�
CaCl2+2NH3��+2H2O����ʯ�ң�
��.Cװ����������ȡ������װ�ã���NaOH��Һ��Cl2����ΪŨ���������ˮ�ԣ����������������壬����ͨ��Ũ���������������ٽ����ռ�����ΪҪ�ռ�����������������ܶȱȿ������������ſ������ռ�����������������˳��ΪE��D��D(��D![]() D)����ȥCl2��Ӧ�Ļ�ѧ����ʽΪCl2+2NaOH=NaCl+NaClO+H2O���ʴ�Ϊ��E��D��D(��D��D)��Cl2+2NaOH=NaCl+NaClO+H2O��
D)����ȥCl2��Ӧ�Ļ�ѧ����ʽΪCl2+2NaOH=NaCl+NaClO+H2O���ʴ�Ϊ��E��D��D(��D��D)��Cl2+2NaOH=NaCl+NaClO+H2O��
��.NH3�Ĵ������Ƿ��ȷ�Ӧ��G���Թ��������ɵ�NO��δ��Ӧ��O2�������ɺ���ɫ����NO2������ʵ������Ϊ��������ɫ�������ʢٵĴ�Ϊ����������ɫ���壻���Ĵ�Ϊ������������Ϊ���ȷ�Ӧ�����ɵ�NO��δ��Ӧ��O2��������NO2��
NO2����N2O4�ķ�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���NO2��������۲쵽������ɫ��dz���ʢ۵Ĵ�Ϊ��������ɫ��dz�����Ĵ�Ϊ���¶Ƚ��ͣ�ƽ��2NO2![]() N2O4�����ƶ�������NO2ת��ΪN2O4
N2O4�����ƶ�������NO2ת��ΪN2O4