题目内容
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O (g)。半水煤气经过下列步骤转化为合成氨的原料。完成下列填空:
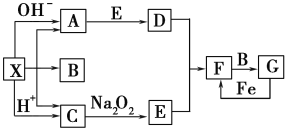
![]()
(1)半水煤气含有少量硫化氢。将半水煤气样品通入 溶液中(填写试剂名称),出现 ,可以证明有硫化氢存在。
(2)写出半水煤气在铜催化下实现CO变换的反应方程式 ;若半水煤气中V(H2): V(CO): V(N2)=9:7:4,经CO变换后的气体中:V(H2): V(N2)=__________。
(3)碱液吸收法是脱除二氧化碳的方法之一。有一吸收了二氧化碳的氢氧化钠洛液,为测定其溶液组成,采用双指示剂法进行滴定。
步骤:用移液管量取V0mL的该溶液于锥形瓶中,先滴入1-2滴酚酞做指示剂,滴定达到终点时用去c mol.L-1的标准盐酸溶液VlmL,此时再向溶液中滴入1-2滴__________做指示剂,达到滴定终点时又用去V2mL标准盐酸溶液。
第二次滴定达到终点时的现象是______________________。
数据处理:通过Vl和V2的相对大小可以定性也可定量判断溶液的组成。
若V1>V2,写出此时的溶质的化学式_______________。
若2V1=V2,写出此时溶液中离子浓度由大到小的顺序_________________。
讨论:若V1<V2,在第一次滴定时未用标准盐酸润洗酸式滴定管,第二次滴定前发现并纠正了错误,则____________(填化学式)浓度偏大。
【答案】
(1)硝酸铅(或硫酸铜);黑色沉淀;
(2)CO+H2O![]() CO2+H2;4:1
CO2+H2;4:1
(3)甲基橙;当最后一滴标准液滴入,溶液恰好由黄色变橙色,且半分钟不变色;
Na2CO3和NaOH;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);Na2CO3
【解析】
试题分析:(1)将水煤气通入硝酸铅(或硫酸铜)溶液中,出现黑色沉淀,证明含有硫化氢,故答案为:硝酸铅(或硫酸铜);黑色沉淀;
(2)若半水煤气中V(H2):V(CO):V(N2)=9:7:4,反应中氮气体积不变,根据方程式:CO+H2O![]() CO2+H2,可知经CO变换后的气体中V(H2):V(N2)=(9+7):4=4:1,故答案为:CO+H2O
CO2+H2,可知经CO变换后的气体中V(H2):V(N2)=(9+7):4=4:1,故答案为:CO+H2O![]() CO2+H2;4:1;
CO2+H2;4:1;
(3)酚酞的变色范围是8.2~10.0,所以第一次变色后碳酸钠转化为碳酸氢钠,如果继续滴定,则需要选择甲基橙作指示剂,终点时的实验现象是当最后一滴标准液滴入,溶液恰好由黄色变橙色,且半分钟不变色;若V1>V2,由于碳酸钠转化为碳酸氢钠以及碳酸氢钠转化为二氧化碳消耗的盐酸一样多,这说明此时的溶质的化学式Na2CO3和NaOH;若2V1=V2,说明溶质是等物质的量的碳酸钠和碳酸氢钠,则此时溶液中离子浓度由大到小的顺序c (Na+) >c(HCO3-) >c (CO32-) >c(OH-) >c (H+);若Vl<V2,在第一次滴定时未用标准盐酸润洗酸式滴定管,则与碳酸钠反应的盐酸体积增加,因此如果第二次滴定前发现并纠正了错误,则碳酸钠的浓度偏大,故答案为:甲基橙;当最后一滴标准液滴入,溶液恰好由黄色变橙色,且半分钟不变色;Na2CO3和NaOH ;c (Na+) >c(HCO3-) >c (CO32-) >c(OH-) >c (H+);Na2CO3。