题目内容
目前,人们正在研究开发一种高能电池---钠硫电池,它是以熔融的钠和硫为两极,以Na+导电的β′—Al2O3陶瓷作固体电解质,反应式如下:Na2Sx 2Na+xS,以下说法正确的是
2Na+xS,以下说法正确的是
 2Na+xS,以下说法正确的是
2Na+xS,以下说法正确的是| A.放电时,Na 作正极,S极发生还原反应 |
| B.充电时钠极与外电源的正极相连 |
| C.当用该电池电解AgNO3溶液时,阳极上产生标准状况下气体11.2L时,消耗金属钠2.3g |
| D.充电时,阳极发生的反应为:Sx2--2e— = xS |
D
放电为题中的逆向反应,是原电池原理,分析化合价得:Na 作负极、S极为正极发生还原反应,故A错误;
当用该电池电解AgNO3溶液时,阳极:4OH--4e-=2H2O+O2↑
4mol 22.4L
2mol 11.2L
则:Na - e-= Na+(利用电子守恒)
23g 1mol
46g 2mol,故C错误;
充电时为电解池,应“负接负、正接正”,即钠极应与外电源的负极相连,故B错误、D正确
当用该电池电解AgNO3溶液时,阳极:4OH--4e-=2H2O+O2↑
4mol 22.4L
2mol 11.2L
则:Na - e-= Na+(利用电子守恒)
23g 1mol
46g 2mol,故C错误;
充电时为电解池,应“负接负、正接正”,即钠极应与外电源的负极相连,故B错误、D正确

练习册系列答案
相关题目
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 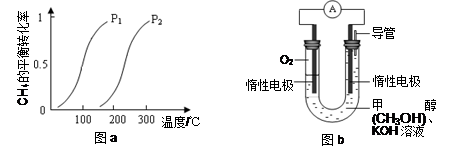
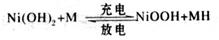
 CH3OH + H2O)
CH3OH + H2O)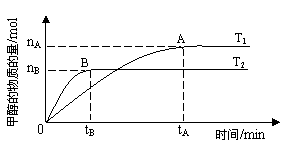
 Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是