题目内容
物质的量浓度都为0.1 mol·L-1的CH3COOH与NaOH溶液等体积混合后,下列关系式不正确的是
| A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| C.c(OH-)=c(H+)+ c(CH3COOH) |
| D.c(CH3COOH)+ c(CH3COO-)= c(Na+) |
A
试题分析:CH3COOH与NaOH溶液等浓度等体积混合后二者恰好完全发生反应:CH3COOH+NaOH= CH3COONa + H2O,得到醋酸钠溶液。A.由于醋酸钠是强碱弱酸盐,醋酸根离子发生水解反应CH3COO- + H2O
 :CH3COOH+OH-.而消耗所以c(Na+)>c(CH3COO-),破坏了水的电离平衡,促使水继续电离,最终当溶液达到平衡时C(H+)<C(OH-)。盐水解的程度是很微弱的,水电离产生的离子的浓度远小于盐的电离,所以c(CH3COO-)> c(OH-)。因此错误。B.根据溶液呈电中性原则,阳离子所带的正电荷总数与阴离子所带的负电荷总数相等可得c(Na+)+c(H+)=c(OH-)+c(CH3COO-)。正确。C.由于醋酸根离子发生水解反应CH3COO- + H2O
:CH3COOH+OH-.而消耗所以c(Na+)>c(CH3COO-),破坏了水的电离平衡,促使水继续电离,最终当溶液达到平衡时C(H+)<C(OH-)。盐水解的程度是很微弱的,水电离产生的离子的浓度远小于盐的电离,所以c(CH3COO-)> c(OH-)。因此错误。B.根据溶液呈电中性原则,阳离子所带的正电荷总数与阴离子所带的负电荷总数相等可得c(Na+)+c(H+)=c(OH-)+c(CH3COO-)。正确。C.由于醋酸根离子发生水解反应CH3COO- + H2O  CH3COOH+OH-使溶液显碱性,所以C(OH-)(水)=C(H+)(剩余)+C(H+)(反应)= C(H+)+C(CH3COOH).故正确。D.根据物料守恒可得c(Na+)= c(CH3COO-)(剩余)+ c(CH3COO-)(消耗)= c(CH3COO-)+ c(CH3COOH)。正确。
CH3COOH+OH-使溶液显碱性,所以C(OH-)(水)=C(H+)(剩余)+C(H+)(反应)= C(H+)+C(CH3COOH).故正确。D.根据物料守恒可得c(Na+)= c(CH3COO-)(剩余)+ c(CH3COO-)(消耗)= c(CH3COO-)+ c(CH3COOH)。正确。
练习册系列答案
相关题目
 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:
的CH3COOH和CH3COONa溶液等体积混合所得的溶液中: )+c(H2CO3)+2c(C
)+c(H2CO3)+2c(C )
)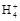 )=c(Cl-)
)=c(Cl-) HCOO-+H3O+
HCOO-+H3O+ HCO3-+OH-平衡。下列说法不正确的是( )
HCO3-+OH-平衡。下列说法不正确的是( )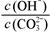 减小
减小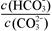 减小
减小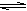 CH3COO- + H3O+
CH3COO- + H3O+