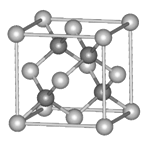
题目内容
【题目】Ⅰ、NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:步骤一:利用NaClO3在硫酸作用下与SO2反应生成ClO2和一种酸式盐。
步骤二:将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2
回答下列问题:
(1)NaClO2中![]() 的化合价为__________。
的化合价为__________。
(2)写出步骤一中生成ClO2的化学方程式 。
(3)步骤二反应中,氧化剂与还原剂的物质的量之比为__________,该反应中氧化产物是 。
Ⅱ、水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性(KOH)KI溶液,生成MnO(OH)2沉淀,密封静置;一段时间后加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:![]()
(1)写出O2将MnSO4氧化成MnO(OH)2的化学方程式: 。
(2)写出MnO(OH)2与I-完全反应生成Mn2+和I2 的化学方程式 。
Ⅲ、在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H2O2+2KI + H2SO4=I2+ O2↑+H2SO4,这个方程式正确吗?
(填“正确”或“不正确”),理由是 。正确的化学反应方程式为 。
【答案】Ⅰ(1)+3(2)2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4(3)2:1,O2
Ⅱ(1)O2+2MnSO4+4KOH=2MnO(OH)2↓ + 2K2SO4
(2)MnO(OH)2+ 2H2SO4 + 2KI = MnSO4 + I2 + 3H2O + K2SO4
Ⅲ不正确,O元素和I元素的化合价均上升,没有化合价降低的元素,H2O2+2KI+H2SO4=2H2O+I2 + K2SO4
【解析】
试题分析:Ⅰ、(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0可得Cl的化合价为+3价。
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,根据电子守恒和原子守恒可知此反应的化学方程式为2NaClO3+SO2+H2SO4=2NaHSO4+ClO2↑。
(3)将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2,其中氯元素的化合价从+4价降低到+3价,得到1个电子,则ClO2是氧化剂。双氧水中氧元素的化合价从-1价升高到0价,失去1个电子,因此双氧水是还原剂,氧气是氧化产物,根据电子得失守恒可知氧化剂与还原剂的物质的量之比为2:1。
Ⅱ、(1)反应中Mn元素化合价从+2价升高到+4价,失去2个电子,氧气在反应中得到4个电子,则根据电子得失守恒可知O2将MnSO4氧化成MnO(OH)2的化学方程式为O2+2MnSO4+4KOH=2MnO(OH)2↓ + 2K2SO4 。
(2)MnO(OH)2与I-完全反应生成Mn2+和I2 的化学方程式为MnO(OH)2+ 2H2SO4 + 2KI = MnSO4 + I2 + 3H2O + K2SO4。
Ⅲ、O元素和I元素的化合价均上升,没有化合价降低的元素,因此说法不正确,正确的方程式为H2O2+2KI+H2SO4=2H2O+I2 + K2SO4。

 阅读快车系列答案
阅读快车系列答案【题目】[化学-选修3:物质结构与性质]
氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。
请回答下列问题:
(1)与氧同周期的相邻元素中,第一电离能由大到小的顺序为_______________。
(2)臭鼬排放的臭气主要成分为3-MBT(3-甲基-2-丁烯硫醇,结构如下图)。
![]()
1mol3-MBT中含有σ键数目为_______________(NA为阿伏伽德罗常数的值)。沸点:3-MBT____________(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是___________________。
(3)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是_____________(填选项字母)。
A.中心原子的价层电子对数目相等 |
B.都是极性分子 |
C.中心原子的孤对电子数目相等 |
D.都含有极性键 |
②SO3分子的空间构型为________,与其互为等电子体的阴离子为_____________(举一例)。将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______。

(4)元素X与硒同周期,X元素原子核外未成对电子数最多,X为________(填元素符号),X的基态原子的电子排布式为_______。
(5)单质钋是由_____键形成的晶体;若已知Po的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为_________g/cm3