题目内容
【题目】Ⅰ:实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为:
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
(1)请将上述化学方程式改写为离子方程式__________________________;
(2)浓盐酸在反应中显示出来的性质是____________ (填写编号);
①只有还原性②还原性和酸性 ③只有氧化性④氧化性和酸性
(3)此反应中氧化产物是___________(填化学式),产生0.5 mol Cl2,则转移的电子的物质的量为___________mol。
(4)用双线桥法表示该反应的电子转移的方向和数目_____________
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
Ⅱ:某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2常温下是深红棕色液体),设计了如下流程图:

已知:可供选择的试剂 a、试剂b(试剂 b代表一组试剂)如下:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液(H+)、KMnO4溶液(H+)、稀盐酸。请根据流程图,回答相关问题:
(5)若试剂a为H2O2溶液(H+),已知H2O2+2KBr+2HCl=Br2+2H2O+2KCl
①发生反应的离子方程式为:__________;
②每消耗0.2molH2O2,反应转移的电子数为______mol;
③还原剂和还原产物的物质的量之比是_______;
(6)操作①②③④⑤对应的名称分别是:______、分液、_____、过滤、______ ;
(7)为了除去无色液体I中的Ca2+、Mg2+、SO42-,从可供选择的试剂中选出试剂b所代表的物质,按滴加顺序依次是____、____、____(填化学式);
(8)调pH=7(中性)是为了除去杂质离子________和_________,以提高氯化钾晶体的纯度。
【答案】2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O ② Cl2 1 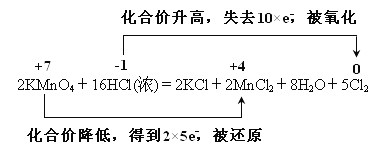 H2O2+2Br-+2H+=Br2+2H2O 0.4 1:1 萃取 蒸馏 蒸发结晶 BaCl2 KOH K2CO3 OH- CO32-
H2O2+2Br-+2H+=Br2+2H2O 0.4 1:1 萃取 蒸馏 蒸发结晶 BaCl2 KOH K2CO3 OH- CO32-
【解析】
I.(1)根据离子方程式拆分原则,把易溶的易电离的物质写成离子形式,把难溶于水或难电离的物质及单质,仍以化学式表示,就改写为离子方程式;
(2)根据化合价变化及氧化还原反应中元素化合价与物质性质关系分析判断盐酸的性质;
(3)根据氧化还原反应中元素的化合价与物质得失电子关系及物质的作用分析判断,并进行计算;
(4)在用双线桥表示电子转移时,桥上要标有元素化合价升高,失去电子数目,被氧化元素;元素化合价降低,获得电子数目,被还原,并且电子得失数目相等;
II. 根据图示可知,制备流程为:废液中加入双氧水,将溴离子氧化成溴单质,然后加入四氯化碳后通过萃取、分液分离出溴,通过操作③蒸馏得到四氯化碳和溴单质;无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,分别加入BaCl2、K2CO3、KOH溶液过滤后得到无色溶液Ⅱ和固体A,再调节溶液Ⅱ的pH,除去碳酸根离子、氢氧根离子,得到无色溶液Ⅲ,最后通过蒸发结晶获得氯化钾固体。
(5)①根据物质的拆分原则,改写化学方程式为离子方程式;
②根据H2O2中O元素化合价的变化分析;
③根据氧化还原反应的基本概念及物质的作用解答;
6)根据分离的各种混合物的成分组成及性质的不同采用不同分离方法;
(7)除去Ca2+,选用饱和K2CO3溶液;除去Mg2+,选用KOH溶液;除去SO42-,选用BaCl2溶液,结合除杂时不能引入新的杂质,或引入新的杂质要容易除去选择合适的滴加顺序;
(8)根据最后得到的物质是KCl,需将溶液II中杂质通过盐酸除去。
(1)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O在溶液中进行中,结合物质存在形式,及离子方程式拆分原则,该反应的离子反应的方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,HCl中的Cl一部分由-1价变为0价的Cl2,失去电子,被氧化,作还原剂;还有一部分Cl元素的化合价没有发生变化,与反应后溶液中的K+、Mn2+结合形成盐,HCl提供的H+与其中的O结合形成H2O,起酸的作用,所以盐酸的作用是酸性、还原性,故合理选项是②;
(3)在此反应中氯元素的化合价升高,失去电子被氧化,所以HCl作还原剂,得到的氯气是氧化产物,化学式为Cl2,产生1mol Cl2,则转移的电子的物质的量为2mol,则生成0.5mol Cl2,则转移的电子的物质的量为1mol;
(4)元素化合价的变化分别为:Mn元素由反应前KMnO4的+7价变成MnCl2中的+2价,化合价降低,得电子2×5e-;生成MnCl2;Cl元素由 HCl中的-1价变成Cl2中的0价,化合价升高,失去5×2×e-,所以双线桥法表示该反应的电子转移的方向和数目为: ;
;
(5)①根据物质的拆分原则,化学方程式H2O2+2KBr+2HCl=Br2+2H2O+2KCl改写的离子方程式为:H2O2+2Br-+2H+=Br2+2H2O;
②在反应H2O2+2KBr+2HCl=Br2+2H2O+2KCl中,O元素的化合价由反应前H2O2中的-1价变为反应后H2O中的-2价,化合价降低,每1个H2O2反应获得电子1e-×2=2e-,所以每消耗0.2molH2O2,反应转移的电子数为0.4mol;
③在反应H2O2+2KBr+2HCl=Br2+2H2O+2KCl中,KBr作还原剂,H2O2作氧化剂,反应产生的H2O是还原产物,所以反应中还原剂与还原产物的物质的量的比是2:2=1:1;
④由流程图知,无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,无色液体Ⅲ中只含有K+、Cl-,则试剂b的作用是除去Ca2+、Mg2+、SO42-;操作①是使H2O2氧化Br-反应产生的Br2进入到CCl4中,该操作是萃取;操作②是将互不相溶的两种液体分开,方法为分液;操作③是将沸点不同、互溶的两液体分开,该分离混合物的操作方法为蒸馏;操作④是将难溶性的固体与溶液混合物分开,该分离混合物的方法是过滤;操作⑤是将KCl从其水溶液中提取出来,可以将溶剂分蒸发得到,该分离混合物的方法称为结晶法,故操作①、②、③、④、⑤的名称是:萃取、分液、蒸馏、过滤、蒸发结晶;
(7)由于除杂时使用的除杂试剂需过量,且不能引入新杂质,所以除去Ca2+,选用饱和K2CO3溶液;除去Mg2+,选用KOH溶液;除去SO42-,选用BaCl2溶液。而且只要满足BaCl2溶液在饱和K2CO3溶液之前加入即可,所以滴加顺序可以是BaCl2溶液、KOH溶液、饱和K2CO3溶液(或KOH溶液、BaCl2溶液、饱和K2CO3溶液或BaCl2溶液、饱和K2CO3溶液、KOH溶液);
(8)根据(7)分析可知无色溶液I经加入试剂b,经过滤后得到的溶液II中含有过量的KOH、K2CO3,向其中加入盐酸,调节溶液的pH=7,此时HCl可以与KOH、K2CO3反应产生KCl,最后经蒸发结晶获得纯净的KCl晶体,所以调pH=7(中性)是为了除去杂质离子OH-和CO32-,以提高氯化钾晶体的纯度。

【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
【题目】氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应N2+3H2![]() 2NH3。该可逆反应达到平衡的标志是________。
2NH3。该可逆反应达到平衡的标志是________。
A.3v正(H2)=2v逆(NH3)
B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中,测得如下表所示数据。
时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
10 | 0.21 | 0.81 | 0.19 | 0.64 |
请回答下列问题:
①该温度下,上述反应的平衡常数K=________;
②反应在7~10 min内,CO的物质的量减少的原因可能是________(填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
③若保持相同的温度,向2 L的恒容密闭容器中同时充入0.2 mol CH4、0.6 mol H2O、a mol CO和0.5 mol H2,当a=0.2时,上述反应向________(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为________(已知:0.253=0.0156)
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.在某溶液中加入盐酸后无现象,再加BaCl2产生白色沉淀证明有SO42- | B.样品中加NaOH溶液加热,蓝色石蕊试纸变红,证明检验样品中有NH4+的存在 | C.将混有少量氯化钾的硝酸钾饱和溶液在冰水中冷却,KNO3晶体先析出 | D.将灼热的铜丝伸入盛有氯气的集气瓶中,铜丝剧烈燃烧,产生棕黄色的烟 |
A.AB.BC.CD.D