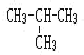题目内容
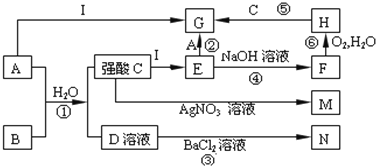
【题目】下图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性;I是一种金属单质;F、M、N均为水的白色沉淀,其中M和N不溶于稀硝酸,C和D是两种常见的强酸。请回答下列问题:
(1)写出①的化学方程式_______________________________________。
(2)写反应②的离子方程式__________________________________________。
(3)写出将A通入石灰乳的化学方程式________________________________________。
(4)在①→⑥中,属于氧化还原反应的有_______________________(填编号)
(5)将NaOH溶液加入到E中的现象为____________________________________。
(6)写出反应⑥的化学反应方程式_______________________________________。
(7)写出分别将A、B通入石蕊试液中的现象:
A__________________B__________________。
【答案】Cl2+SO2+2H2O=H2SO4+2HCl 2Fe2++Cl2=2Fe3++2Cl- 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+ 2H2O ①②⑥ 生成白色沉淀,马上变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 石蕊试液先变红,后褪色 石蕊试液变红
【解析】
A和B常温下都是气体,且水溶液都有漂白性,A应为Cl2,B应为SO2,M和N不溶
于稀硝酸,可知M为AgCl,N为BaSO4,则C为HCl,D为H2SO4,由转化关系可知I为Fe,E
为FeCl2,F为Fe(OH)2,H为Fe(OH)3,G为FeCl3。
(1)①反应为Cl2和SO2在水中反应生成硫酸和盐酸,反应的化学方程式为Cl2+SO2+2H2O=H2SO4+2HCl,故答案为:Cl2+SO2+2H2O=H2SO4+2HCl;
(2)反应②为氯化亚铁与氯气反应生成氯化铁,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)氯气与石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=
CaCl2+Ca(ClO)2+ 2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+ 2H2O;
(4)反应①中Cl元素的化合价降低,S元素的化合价降低,反应②中Cl元素的化合价降低,Fe元素的化合价升高,反应⑥中Fe元素的化合价升高,O元素的化合价降低,而其他反应中没有元素的化合价变化,所以①②⑥属于氧化还原反应,故答案为:①②⑥;
(5)将NaOH溶液加入到FeCl2溶液中,立即生成氢氧化亚铁白色沉淀,氢氧化亚铁白色沉淀迅速变为灰绿色,最终变成红褐色,故答案为:生成白色沉淀,马上变成灰绿色,最终变成红褐色;
(6)反应⑥氢氧化亚铁在空气中放置,被空气中氧气氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(7)将氯气通入石蕊试液中,氯气与水反应生成盐酸和次氯酸,使溶液变红色,因次氯酸具有强氧化性,使红色溶液漂白褪色,将二氧化硫通入石蕊试液中,二氧化硫与水反应生成亚硫酸,使溶液变红色,故答案为:石蕊试液先变红,后褪色;石蕊试液变红。