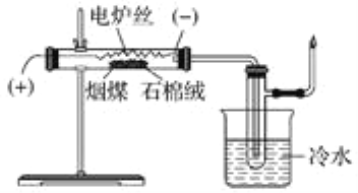
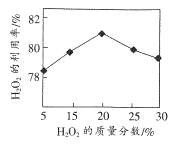
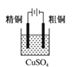
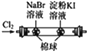
题目内容
【题目】镍、铂、镧等过渡金属单质及化合物在医疗领域有着广泛的应用。
(1)基态原子镍的价电子排布式为_______。
(2)抗癌药奥沙利铂(又名乙二酸铂)的结构简式如图所示。

①分子中氮原子轨道的杂化类型是_________,C、N、O三种元素的第一电离能由大到小的顺序为_____。
②1 mol乙二酸分子中含有σ键的数目为________________。
(3)碳酸镧[La2(CO3)3]可用于治疗高磷血症。写出与CO32-互为等电子体的一种分子的化学式: _______。
(4)镧镰合金可用于储氢,储氢之后所得晶体的化学式为LaNi5(H2)3,其晶体的最小重复结构单元如图所示(◎、O、●代表储氢之后晶体中的三种微粒)。图中●代表的微粒是_______。

【答案】 3d84s2 sp3 N>O>C 7NA SO3 H2
【解析】(1)Ni的原子序数为28,电子排布式为1s22s22p63s23p63d84s2,则价电子排布式是3d84s2;(2) ①抗癌药奥沙利铂分子中氮原子价电子数=![]() ,为sp3杂化;C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C;②单键都是σ键,双键中其一个是σ键一个是π键,1个乙二酸分子一共7个σ键,2个π键,故1 mol乙二酸分子中含有σ键的数目为7NA;(3)等电子体是指具有相同价电子数目和原子数目的分子或离子,与CO32-互为等电子体的分子的化学式为:SO3;(4)根据均摊法计算,◎的个数为8×
,为sp3杂化;C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C;②单键都是σ键,双键中其一个是σ键一个是π键,1个乙二酸分子一共7个σ键,2个π键,故1 mol乙二酸分子中含有σ键的数目为7NA;(3)等电子体是指具有相同价电子数目和原子数目的分子或离子,与CO32-互为等电子体的分子的化学式为:SO3;(4)根据均摊法计算,◎的个数为8×![]() =1,O的个数为8×
=1,O的个数为8×![]() +1=5,●的个数为8×
+1=5,●的个数为8×![]() +1=3,根据化学式LaNi5(H2)3可知,图中●代表的微粒是H2。
+1=3,根据化学式LaNi5(H2)3可知,图中●代表的微粒是H2。

【题目】下列实验方案的设计与评价合理的是 (_____)
A | B | C | D |
|
|
|
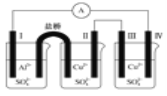
Ⅰ为Al电极,其他均为Cu电极 |
| 验证氧化性:Cl2>Br2>I2 | 验证温度对平衡移动的影响 | 电子流动方向:电极Ⅳ→A→电极Ⅰ |
A. A B. B C. C D. D
【题目】某同学探究SO2使品红溶液褪色的过程,将SO2通入水中得到pH=2的溶液A,后续操作如下,下列说法不正确的是
实验1 |
|
实验2 |
|
A. 溶液A的pH=2原因是:SO2 + H2O![]() H2SO3
H2SO3 ![]() H+ + HSO3-
H+ + HSO3-
B. 实验1、实验2均体现了SO2的还原性和漂白性
C. 经实验1、2对比可知品红溶液褪色的过程是可逆的
D. 实验2中加入NaOH溶液调节pH =2 的原因是排除H+浓度变化产生的干扰