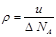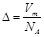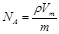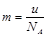题目内容
钠及其化合物在生产和生活中有广泛的应用。例如:Na2O2在医院、潜水、高空飞行中用作供氧剂。
(1)制备Na2O2的反应为:4Na+O2 2Na2O 2Na2O +O2
2Na2O 2Na2O +O2 2Na2O2 。
2Na2O2 。
①实验测得某过氧化钠样品含有少量氧化钠杂质,其中钠、氧原子个数比为10︰9.5,该样品中Na2O2的纯度为 。
②取上述过氧化钠样品7.64g放入烧杯中,加入足量水,搅拌,使固体完全溶解,冷却后,在容量瓶中配制成100mL溶液,则该溶液中OH-离子的物质的量浓度为 。
(2)某同学为了检验引起光化学烟雾的气体成分(NO、CO、NO2、HCHO、CH3OH、CH4等),查阅资料得知:Na2O2+2NO→2NaNO2、Na2O2+2NO2→2NaNO3,于是取用a gM气体与b g 氧气混合后,用电火花不断引燃,充分反应后,气体通过足量Na2O2,Na2O2固体质量增加c g。
①若a=c,则M气体的成分可能含有 。
②若2a=c,则M气体可能是什么气体?通过计算回答。
(1)制备Na2O2的反应为:4Na+O2
 2Na2O 2Na2O +O2
2Na2O 2Na2O +O2 2Na2O2 。
2Na2O2 。①实验测得某过氧化钠样品含有少量氧化钠杂质,其中钠、氧原子个数比为10︰9.5,该样品中Na2O2的纯度为 。
②取上述过氧化钠样品7.64g放入烧杯中,加入足量水,搅拌,使固体完全溶解,冷却后,在容量瓶中配制成100mL溶液,则该溶液中OH-离子的物质的量浓度为 。
(2)某同学为了检验引起光化学烟雾的气体成分(NO、CO、NO2、HCHO、CH3OH、CH4等),查阅资料得知:Na2O2+2NO→2NaNO2、Na2O2+2NO2→2NaNO3,于是取用a gM气体与b g 氧气混合后,用电火花不断引燃,充分反应后,气体通过足量Na2O2,Na2O2固体质量增加c g。
①若a=c,则M气体的成分可能含有 。
②若2a=c,则M气体可能是什么气体?通过计算回答。
(本题共12分)(1) ①91.9% (2分) ②2.00mol/L (共3分)
(2) ① NO、CO、NO2、HCHO、CH3OH (答对3种1分,全对3分)提示:当它们与氧气反应后的的产物与过氧化钠反应,增重的部分就是其自身。
②CH4(共4分、计算过程合理1分)提示:当甲烷与氧气反应时,生成的产物与过氧化钠反应,增重的是CH4·O,即一倍于甲烷的质量。
(2) ① NO、CO、NO2、HCHO、CH3OH (答对3种1分,全对3分)提示:当它们与氧气反应后的的产物与过氧化钠反应,增重的部分就是其自身。
②CH4(共4分、计算过程合理1分)提示:当甲烷与氧气反应时,生成的产物与过氧化钠反应,增重的是CH4·O,即一倍于甲烷的质量。
试题分析:(1) ①设样品中氧化钠和过氧化钠的物质的量分别是x和y,根据钠、氧原子个数比为10︰9.5可知,(2x+2y):(x+2y)=10:9.5,解得y=9x,所以样品中过氧化钠的纯度是
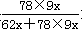 ×100%=91.9%。
×100%=91.9%。②7.64g样品中过氧化钠的质量是7.64g×91.9%=7.0g,所以过氧化钠的物质的量是7.0g÷78g/mol=0.09mol,所以氧化钠的物质的量是0.01mol。根据钠原子守恒可知,溶液中氢氧化钠的物质的量是0.09mol×2+0.01mol×2=0.2mol,所以溶液中OH-的浓度=0.2mol÷0.1L=2.00mol/L。
(2)①若a=c,这说明固体增加的质量就是气体的质量,则根据方程式Na2O2+2NO→2NaNO2、Na2O2+2NO2→2NaNO3可知,气体可能含有NO、NO2。又因为CO+Na2O2→Na2CO3、H2+Na2O2→2NaOH,这说明气体的组成只要满足(CO)n(H2)m即可保证燃烧后的气体通过过氧化钠时,过氧化钠增加的质量就是气体的质量,因此气体还可能含有CO、HCHO、CH3OH。
②若2a=c,这说明固体增加的质量是气体质量的2倍,因此最终参加反应的氧气的质量恰好等于气体的质量。根据方程式2CnHmOz+(m+2n)Na2O2+(n-z) O2→2mNaOH+2nNa2CO3可知,24n+2m+32z=32n-32z,解得4n=m+32z,所以只有当n=1、m=4、z=0时成立,即该气体是甲烷。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目