题目内容
Vm、ρ分别表示标准状况下,氩气的摩尔体积和密度, m、?分别表示每个氩分子的质量和体积,u表示氩气的摩尔质量, NA为阿伏伽德罗常数,下面关系式中正确的是
A.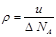 | B.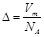 | C.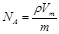 | D.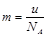 |
CD
试题分析:A、依据标准状况下气体的摩尔体积可知,气体的摩尔质量u=ρVm,所以
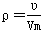 ,这说明气体体积与分子体积无关,故A错误;B、气体体积不是分子体积之和,故B错误;C、气体摩尔质量u=mNA=ρVm,得到
,这说明气体体积与分子体积无关,故A错误;B、气体体积不是分子体积之和,故B错误;C、气体摩尔质量u=mNA=ρVm,得到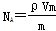 ,故C正确;D、阿伏加德罗常数NA个原子的质量之和在数值上等于摩尔质量,所以
,故C正确;D、阿伏加德罗常数NA个原子的质量之和在数值上等于摩尔质量,所以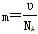 ,故D正确,答案选CD。
,故D正确,答案选CD。
练习册系列答案
相关题目

 Na2S + 4CO↑ ②Na2SO4 + 4CO
Na2S + 4CO↑ ②Na2SO4 + 4CO 2Na2O 2Na2O +O2
2Na2O 2Na2O +O2 2Na2O2 。
2Na2O2 。