题目内容
【题目】据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及碳氧化物是许多城市大气污染的主要污染物。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1=393.5kJ·mol1
2C(s)+O2(g)=2CO(g) △H2=221.0kJ·mol1
N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式___。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
下列能说明该反应已经达到平衡状态的是___(填字母代号)。
A.![]() 比值不变
比值不变
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。
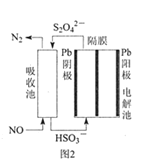
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式__。用离子方程式表示吸收池中除去NO的原理___。
(4)T1温度时在容积为2L的恒容密闭容器中发生反应:2CO(g)+O2(g)![]() 2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 2 | 1.2 | 0.8 | 0.4 | 0.4 | 0.4 |
n(O2)/mol | 1.2 | 0.8 | 0.6 | 0.4 | 0.4 | 0.4 |
①T1温度时![]() =___L/mol。
=___L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__T1(填“>”、“<”或“=")。
II.“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。在0.1MPa、Ru/TiO2催化下,将一定量的H2和CO2置于恒容密闭容器中发生反应X:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
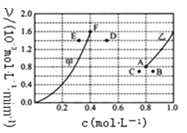
(5)为探究反应X的反应速率与浓度的关系,向恒容密闭容器中通入浓度均为1.0molL-1的H2与CO2。恒温条件下,根据相关数据绘制出反应速率与浓度关系曲线:v正~c(CO2)和v逆~c(H2O)。则与曲线v正~c(CO2)相对应的是如图___曲线。(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线乙对应的平衡点可能为___(填字母)。
(6)温度为T时,向10L密闭容器中充入5molH2和CO2的混合气体,此时容器内压强为5P,两种气体的平衡转化率ɑ与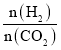 的关系如图所示:
的关系如图所示:
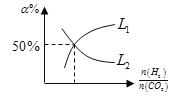
①图中CO2的平衡转化率可用表示___(L1或L2)
②该温度下,反应X的平衡常数Kp=___。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJmol-1 AD 2HSO3-+2e-+2H+=S2O42-+2H2O 2NO+2S2O42-+2H2O=N2+4HSO3- 80 > 乙 C L1 ![]()
【解析】
(1)根据盖斯定律进行计算;
(2)根据平衡状态判断的依据:正逆反应速率相等,各组分浓度保持不变及由此衍生的其他物理量进行分析。
(3)电解池中阴极得电子发生还原反应,根据图2所示,HSO3-得电子生成S2O42-,发生还原反应;吸收池中NO和S2O42-发生氧化还原反应,根据图示的产物可写出该反应的离子方程式;
(4)①反应达到平衡时v正= v逆,即k正c2(CO)·c(O2)= k逆c2(CO2),所以此时![]() ,根据表格数据可知初始投料为2molCO和1.2molO2,平衡时n(CO)=0.4mol,n(O2)=0.4mol,根据反应方程式可知生成的n(CO2)=1.6mol,容器的体积为2L,可以计算出
,根据表格数据可知初始投料为2molCO和1.2molO2,平衡时n(CO)=0.4mol,n(O2)=0.4mol,根据反应方程式可知生成的n(CO2)=1.6mol,容器的体积为2L,可以计算出![]() ;
;
②T2时其k正=k逆,即![]() =K=1<80;该反应焓变小于零即正反应放热反应,平衡常数变小,据此分析温度的大小;
=K=1<80;该反应焓变小于零即正反应放热反应,平衡常数变小,据此分析温度的大小;
(5)初始投料为浓度均为1.0molL-1的H2与CO2,则反应过程中CO2的浓度减小,所以与曲线v正~c(CO2)相对应的是曲线乙;该反应正反应为放热反应,所以降低温度平衡正向移动c(CO2)在原平衡基础上减小,且温度降低反应速率减慢,所以对应的平衡点应为C;
(6)①当CO2的量一定时,增大H2的量,CO2的转化率增大;
②当反应物投料比等于方程式中计量数之比时平衡转化率相等,二者平衡转化率相同时转化率为50%,即当![]() =
=![]() 时,转化率为50%,共充入5molH2和CO2的混合气体,则n(H2)=4mol,n(CO2)=1mol,列三段式进行相关计算,以p(CO2)、p(H2)、p(H2O)来表示平衡时各物质的浓度,进而计算出Kp。
时,转化率为50%,共充入5molH2和CO2的混合气体,则n(H2)=4mol,n(CO2)=1mol,列三段式进行相关计算,以p(CO2)、p(H2)、p(H2O)来表示平衡时各物质的浓度,进而计算出Kp。
(1)CO和NO两种尾气在催化剂作用下生成N2的方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g);已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJmol-1
②2C(s)+O2(g)=2CO(g) △H2=221.0kJ·mol1
③N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol1
①×2-②-③可得目标反应方程式,根据盖斯定律可知目标反应方程式△H=-393.5kJmol-1×2+221.0kJ·mol1-180.5kJ·mol1=-746.5 kJmol-1,
所以CO和NO两种尾气在催化剂作用下生成N2的热化学方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJmol-1;
(2)A.初始投料为0.1molNO和0.3molCO,所以平衡前NO浓度减小,CO2浓度增大,所以当![]() 比值不变时说明反应达到平衡,故A选;
比值不变时说明反应达到平衡,故A选;
B.容器体积不变,即气体的体积不变,反应物和生成物都是气体,所以气体的总质量不变,则混合气体的密度一直不变,故B不选;
C.反应平衡时v(N2)正= v(N2)逆,2v(N2)逆=v(NO)逆,故C不选;
D.平衡正向移动时气体的物质的量减小,气体总质量不变,所以平均摩尔质量增大,当混合气体平均摩尔质量不变时说明反应达到平衡,故D选;
综上所述选AD;
(3)电解池中阴极得电子发生还原反应,根据图2所示,进入阴极室的是HSO3-,流出阴极室的是S2O42-,即HSO3-得电子生成S2O42-,阴极室中溶液的pH在4~7之间,呈酸性,故电极反应为2HSO3-+2e-+2H+=S2/span>O42-+2H2O;吸收池中NO和S2O42-发生氧化还原反应,根据图示的产物可知,NO得电子生成N2,S2O42-失电子生成HSO3-,根据得失电子守恒写出反应的离子方程式为2NO+2S2O42-+2H2O=N2+4HSO3-;
(4)①反应达到平衡时v正= v逆,即k正c2(CO)·c(O2)= k逆c2(CO2),所以此时![]() ,根据表格数据可知初始投料为2molCO和1.2mol O2,平衡时n(CO)=0.4mol,n(O2)=0.4mol,根据反应方程式可知生成的n(CO2)=1.6mol,容器的体积为2L,所以
,根据表格数据可知初始投料为2molCO和1.2mol O2,平衡时n(CO)=0.4mol,n(O2)=0.4mol,根据反应方程式可知生成的n(CO2)=1.6mol,容器的体积为2L,所以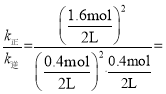 80 L/mol;
80 L/mol;
②T2时其k正=k逆,即![]() =K=1<80;该反应焓变小于零即正反应放热反应,平衡常数变小说明温度升高,所以T2>T1;
=K=1<80;该反应焓变小于零即正反应放热反应,平衡常数变小说明温度升高,所以T2>T1;
(5)初始投料为浓度均为1.0molL-1的H2与CO2,则反应过程中CO2的浓度减小,所以与曲线v正~c(CO2)相对应的是曲线乙;该反应正反应为放热反应,所以降低温度平衡正向移动c(CO2)在原平衡基础上减小,且温度降低反应速率减慢,所以对应的平衡点应为C;
(6)①当CO2的量一定时,增大H2的量,CO2的转化率增大,即![]() 越大,CO2的转化率越大,所以CO2的平衡转化率可用L1表示;
越大,CO2的转化率越大,所以CO2的平衡转化率可用L1表示;
②当反应物投料比等于方程式中计量数之比时平衡转化率相等,二者平衡转化率相同时转化率为50%,即当![]() =
=![]() 时,转化率为50%,共充入5molH2和CO2的混合气体,则n(H2)=4mol,n(CO2)=1mol,列三段式有:
时,转化率为50%,共充入5molH2和CO2的混合气体,则n(H2)=4mol,n(CO2)=1mol,列三段式有:

平衡时气体总物质的量为0.5mol+2mol+0.5mol+1mol=4mol,反应前气体总物质的量为5mol,压强为5P,则反应后总压强为4P,p(CO2)= p(CH4)=![]() P,p(H2)=2P,p(H2O)=P,所以Kp=
P,p(H2)=2P,p(H2O)=P,所以Kp=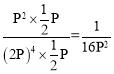 。
。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案