题目内容
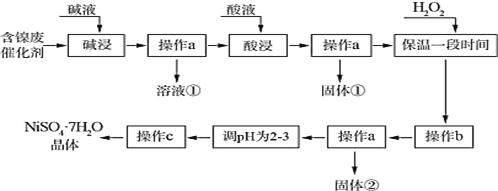
【题目】七水合硫酸镍为水绿色斜方棱形晶体,有甜味,俗称“翠矾”。某学习小组用含镍催化剂废渣(主要成分是镍单质,含少量铁、铝单质及其氧化物,以及少量难溶性杂质),制备七水合硫酸镍晶体,流程图如下:
几种难溶碱开始沉淀和完全沉淀的 pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀 | 3.8 | 2.7 | 7.6 | 7.1 |
完全沉淀 | 5.2 | 3.2 | 9.7 | 9.2 |
回答下列问题:
(1)“碱浸”操作发生的离子方程式为____________。
(2)①“固体①”的主要成分是__________,双氧水作用为___________。
②如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是_______________________,设计实验证明产品中是否含“杂质”:____________。(不考虑硫酸镍影响)
(3) “操作 b”中调节溶液 pH 范围是_________,“操作 c”之前,“调节 pH 为 2~3”的目的是_______。
(4) “操作 c”具体是指___________________、过滤、洗涤、干燥。
(5)取 4.000 g 硫酸镍晶体产品(NiSO4·7H2O)于锥形瓶中,加入足量的去离子水溶解,用0.2000 mol·L-1 的标准溶液EDTA(Na2H2Y)滴定至终点(发生Ni2++ H2Y2- = NiY2-+ 2H+ ),三次实验消耗标准液的体积分别为 69.10 mL、68.90 mL、59.00 mL,则产品纯度为_________%。(计算结果保留到小数点后 2 位,不考虑杂质反应)。
【答案】2A1 + 2OH- + 2H2O=2A1O2- + 3H2↑、Al2O3 +2OH- =2A1O2- + H2O 难溶性杂质 将Fe2+氧化为Fe3+,且不引入新杂质 产品中混有绿矾(FeSO4·7H2O ) 取少量样品加入蒸馏水溶解,滴加铁氰化钾溶液,产生蓝色沉淀,则产品中含有Fe2+ 3.2≤pH<7.1 抑制Ni2+水解 蒸发浓缩、冷却结晶 96.95
【解析】
镍催化剂废渣(主要成分是镍单质,含少量铁、铝单质及其氧化物,以及少量难溶性杂质)碱浸,铝单质及其氧化物溶解生成偏铝酸钠,过滤后所得溶液①的成分为NaAlO2;滤渣中含有镍单质、铁及其氧化物、难溶性杂质;酸浸后镍、铁及其氧化物溶解生成硫酸镍、硫酸铁及硫酸亚铁;过滤后所得固体①为难溶性杂质,滤液中加入H2O2将Fe2+完全氧化为Fe3+,然后调节pH将Fe3+生成Fe(OH)3,但不能让Ni2+生成沉淀,过滤所得固体②的成分为Fe(OH)3;然后再调节pH,也就是增大溶液的酸性,防止Ni2+水解生成Ni(OH)2沉淀,再蒸发结晶便可获得NiSO4·7H2O晶体。
(1)铝单质及其氧化物溶解生成偏铝酸钠,“碱浸”操作发生的离子方程式为2A1 + 2OH- + 2H2O=2A1O2- + 3H2↑、Al2O3 +2OH- =2A1O2- + H2O;答案为:2A1 + 2OH- + 2H2O=2A1O2- + 3H2↑、Al2O3 +2OH- =2A1O2- + H2O;
(2)①由以上分析知,“固体①”的主要成分是难溶性杂质;滤液中加入H2O2是为了将Fe2+转化为Fe3+,所以双氧水的作用为:将Fe2+氧化为Fe3+,且不引入新杂质;答案为:难溶性杂质;将Fe2+氧化为Fe3+,且不引入新杂质;
②如果加入双氧水量不足或“保温时间较短”,则Fe2+有一部分未被氧化为Fe3+,对实验结果的影响是产品中混有绿矾(FeSO4·7H2O),证明产品中是否含“杂质”,即检验Fe2+的存在,设计实验为:取少量样品加入蒸馏水溶解,滴加铁氰化钾溶液,产生蓝色沉淀,则产品中含有Fe2+;答案为:产品中混有绿矾(FeSO4·7H2O);取少量样品加入蒸馏水溶解,滴加铁氰化钾溶液,产生蓝色沉淀,则产品中含有Fe2+;
(3) “操作 b”中调节溶液 pH,应让Fe3+完全转化为Fe(OH)3沉淀,但不能让Ni2+生成沉淀,其范围是3.2≤pH<7.1;由以上分析知,“操作 c”之前,“调节 pH 为 2~3”的目的是抑制Ni2+水解。答案为:3.2≤pH<7.1;抑制Ni2+水解;
(4)从溶液中提取溶质,应进行蒸发结晶,所以 “操作 c”具体是指蒸发浓缩、冷却结晶、过滤、洗涤、干燥;答案为:蒸发浓缩、冷却结晶;
(5)三次实验消耗标准液的体积分别为69.10mL、68.90mL、59.00mL,其中59.00mL偏差太大,应舍去,然后计算69.10mL、68.90 mL的平均值为69.00 mL。
从反应方程式看,Ni2+—H2Y2-—NiSO4·7H2O,从而得出产品纯度为![]() =96.95%;答案为:96.95。
=96.95%;答案为:96.95。