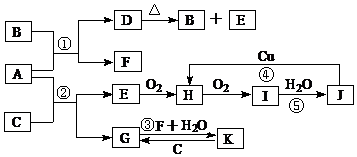
��Ŀ����
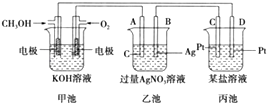
����Ŀ��һ������ȼ�ϵ�أ������������������缫����KOH��Һ�У�Ȼ���������Ϸֱ�ͨ��������������ط�ӦΪ��
X����CH4+10OH����8e��=CO32��+7H2O
Y����O2+4e��+2H2O=4OH��
���й��ڴ�ȼ�ϵ�ص��й�˵���д�����ǣ� ��
A.ͨ������ĵ缫��X��Ϊ��صĸ�����ͨ�������ĵ缫��Y��Ϊ�������
B.�ŵ�һ��ʱ��������Һ��KOH�����ʵ������ı�
C.�ڱ�״���£�ͨ��5.6L��������ȫ��Ӧ����1.0mol�ĵ��ӷ���ת��
D.�ŵ�ʱ��ͨ�������һ��������pH����
���𰸡�B
���������⣺A������ԭ����ܷ�Ӧʽ��֪���鱻������ӦΪԭ��صĸ�����Ӧ�������õ��ӱ���ԭ��ӦΪԭ��ص�������Ӧ��ͨ����ĵ缫��X��Ϊ��صĸ�����ͨ�����ĵ缫��Y��Ϊ�����������A��ȷ��
B�������ܷ���ʽCH4+2O2+2OH���TCO32��+2H2O��֪��Ӧ����KOH��KOH�����ʵ����ı䣬��B����
C��n��O2��= ![]() =0.25mol��ת�Ƶ��ӵ����ʵ���Ϊ0.25mol��4=1mol����C��ȷ��
=0.25mol��ת�Ƶ��ӵ����ʵ���Ϊ0.25mol��4=1mol����C��ȷ��
D�������ڸ�������������Ӧ��ͨ������缫�ĵ缫��ӦΪCH4+10OH����8e��=CO32��+7H2O�����Ը���������pH���ͣ���D��ȷ��
��ѡB��

��ϰ��ϵ�д�
�����Ŀ