题目内容
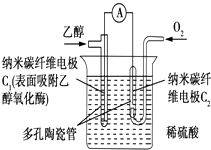
【题目】如图所示是一个电化学装置的示意图. 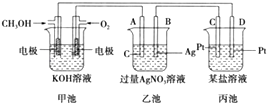
请回答下列问题:
(1)图中丙池是(填“原电池”、“电解池”或“电镀池”).
(2)B电极的名称是(填“正极”、“负极”、“阴极”或“阳极”).
(3)写出通人CH3OH的电极的电极反应式: .
(4)乙池中反应的化学方程式为 .
(5)当乙池中B(Ag)极质量增加10.8g时,甲池中理论上消耗O2的体积为L(标准状况),此时丙池中某电极析出3.2g某金属,则丙池中的某盐溶液可能是(填字母).
A. MgSO4 B.CuSO4C.CuCl2 D.AgNO3 .
【答案】
(1)电解池
(2)阴极
(3)CH3OH﹣6e﹣+8OH﹣═6H2O+CO32﹣
(4)4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
(5)0.56;BC
【解析】解:(1)图中甲池能自发进行氧化还原反应,将化学能转化为电能,属于原电池,乙池和丙池属于电解池,丙池中两个电极一样,不是电镀池,所以答案是:电解池;(2)通入甲醇的电极为负极、通入氧气的电极为正极,A连接原电池正极,为电解池阳极,B是阴极,所以答案是:阴极;(3)甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH﹣6e﹣+8OH﹣═6H2O+CO32﹣ , 所以答案是:CH3OH﹣6e﹣+8OH﹣═6H2O+CO32﹣;(4)乙池中A电极上氢氧根离子放电、阴极上银离子放电,所以乙池电池反应式为4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3 , 所以答案是:4AgNO3+2H2O
4Ag+O2↑+4HNO3 , 所以答案是:4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3;(5)B(Ag)极的质量增加10.8g时,n(Ag)=
4Ag+O2↑+4HNO3;(5)B(Ag)极的质量增加10.8g时,n(Ag)= ![]() =0.1mol,则转移电子为0.1mol,根据转移电子相等,甲池中理论上消耗O2的体积=
=0.1mol,则转移电子为0.1mol,根据转移电子相等,甲池中理论上消耗O2的体积= ![]() ×22.4L/mol=0.56L,此时丙池中某电极析出3.2g某金属,转移电子为0.1mol,所以金属偶的摩尔质量是64g/mol,所以电解质是含有铜离子的盐溶液,故选BC.
×22.4L/mol=0.56L,此时丙池中某电极析出3.2g某金属,转移电子为0.1mol,所以金属偶的摩尔质量是64g/mol,所以电解质是含有铜离子的盐溶液,故选BC.