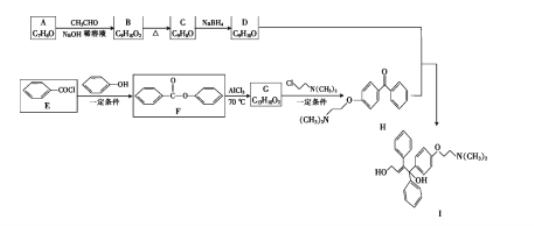
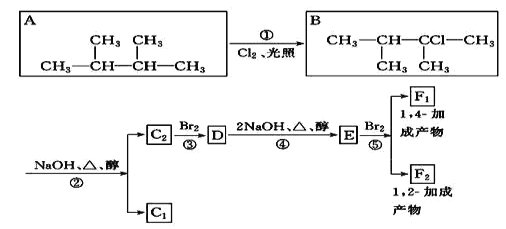
题目内容
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe]是医疗上常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组同学拟用下图装置先制备FeCO3,再用FeCO3与葡萄糖酸反应进一步制得葡萄糖酸亚铁。
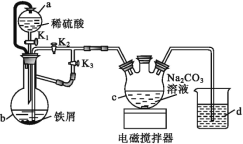
请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是___。
(2)按如图连接好装置,检査气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象___。
②一段时间后,关闭___,打开___(选填“K1”“K2”或“K3”),观察到b中的溶液会流入c中,同时c中析出FeCO3沉淀。
③b中产生的气体的作用是___。
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:___。
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是___。向上述溶液中加入乙醇即可析出产品,加入乙醇的目的是___。
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是___。
【答案】平衡气压,利于稀硫酸顺利流下 铁屑溶解,溶液变为浅绿色,有大量气泡产生 K3 K2 排出装置内的空气,防止生成的FeCO3被氧化;把b中溶液压进c中 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2 抑制Fe2+的水解 降低溶剂的极性,使晶体的溶解量减小更易析出 溶液的pH降低,减少氢氧化亚铁杂质的生成
【解析】
稀硫酸和Fe反应生成氢气,将装置中气体排出,防止亚铁离子被氧化;通过气体压强将b中硫酸亚铁排出,在三颈瓶中硫酸亚铁和碳酸钠反应生成碳酸亚铁,再用碳酸亚铁和葡萄糖酸反应生成葡萄糖酸亚铁。
(1)a为恒压滴液漏斗,可以保证内部压强不变,使漏斗内液体顺利流下;故答案为:平衡气压,利于稀硫酸顺利流下;
(2)①b中铁屑与稀硫酸反应,铁屑会逐渐溶解,溶液由于产生Fe2+变为浅绿色,并有大量气泡产生;故答案为:铁屑溶解,溶液变为浅绿色,有大量气泡产生;
②反应一段时间后,需要把FeSO4加到c中,所以需要关闭K3,打开K2,利用产生的气体把FeSO4压入到c中;故答案为: K3;K2;
③FeCO3易被氧化,b中反应产生的H2一是把装置内的空气排干净,防止生成的FeCO3被氧化;二是把b中溶液压进c中;故答案为:排出装置内的空气,防止生成的FeCO3被氧化,把b中溶液压进c中;
(3)过滤时间过长会发现产品部分变为红褐色,原因是FeCO3与O2及H2O反应生成Fe(OH)3,化学方程式为4FeCO3+O2+6H2O=4Fe(OH)3+4CO2;故答案为:4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
(4)Fe2+易发生水解,将溶液的pH调节至5.8,可抑制Fe2+的水解;乙醇分子的极性比水小,可以降低葡萄糖酸亚铁在水中的溶解量,便于葡萄糖酸亚铁析出;故答案为:抑制Fe2+的水解;降低溶剂的极性,使晶体的溶解量减小更易析出;
(5)碳酸根离子水解后溶液碱性较强,易生成氢氧化亚铁,用NaHCO3溶液代替Na2CO3溶液可以降低溶液的pH,以免产生氢氧化亚铁,得到的产品纯度更高;故答案为:溶液的pH降低,减少氢氧化亚铁杂质的生成。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
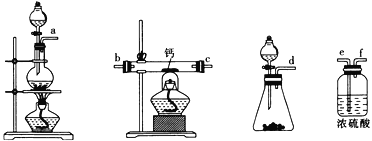
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。

①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。