题目内容
18.常温下,以下三种物质度积常数为:Ksp[Mg(OH)2]=1.2×10-11、Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=8.3×10-9.下列说法正确的是( )| A. | 温度升高,Ksp(AgCl)不变 | |
| B. | 向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大 | |
| C. | 常温下,将0.001 mol•L-1 AgNO3溶液滴入0.001 mol•L-1 KCl和 0.001 mol•L-1 K2CrO4溶液先产生Ag2CrO4沉淀 | |
| D. | 在Mg2+为0.12 mol•L-1的溶液中要产生Mg(OH)2沉淀,应控制溶液的pH>9 |
分析 A、温度升高,AgCl的溶解平衡右移,据此分析Ksp的变化;
B、Ksp只受温度的影响,与其他因素无关;
C、根据Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=8.3×10-9分别求出生成AgCl和Ag2CrO4沉淀所需的c(Ag+),所需的c(Ag+)越小,越先生成沉淀;
D、根据氢氧化镁的Ksp[Mg(OH)2]=1.2×10-11来计算.
解答 解:A、温度升高,AgCl的溶解平衡右移,则Ksp(AgCl)变大,故A正确;
B、Ksp只受温度的影响,与其他因素无关,故B错误;
C、设当生成氯化银沉淀时,所需的c(Ag+)为xmol/L,根据Ksp(AgCl)=1.8×10-10可知,0.001mol/L×xmol/L=1.8×10-10,解得x=1.8×10-7mol/L;
设当生成Ag2CrO4沉淀时,所需的c(Ag+)为ymol/L,根据Ksp(Ag2CrO4)=8.3×10-9可知,(xmol/L)2×0.001mol/L=8.3×10-9,解得y=$\sqrt{8.2}$×10-3mol/L.
由于生成氯化银沉淀时,所需的c(Ag+)小于生成Ag2CrO4沉淀时,所需的c(Ag+),故先生成氯化银沉淀,故C错误;
D、设要产生Mg(OH)2沉淀所需氢氧根的浓度为c(OH-),根据氢氧化镁的Ksp[Mg(OH)2]=1.2×10-11可知,0.12mol/L×c(OH-)2=1.2×10-11,解得c(OH-)=10-5mol/L,此时溶液中的c(H+)=10-9mol/L,即溶液的pH=9,故要生成氢氧化镁沉淀,必须控制溶液的pH>9,故D正确.
故选D.
点评 本题考查了沉淀的溶解平衡和溶度积Ksp的有关计算,应注意的是Ksp只受温度的影响,与其他因素无关.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | 原子半径:Al>Mg>F | B. | 结合质子能力:OH->CH3COO->Cl- | ||
| C. | 热稳定性:HF>H2S>H2O | D. | 碱性:NaOH>KOH>Mg(OH)2 |
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油产品都可用于聚合反应 | |
| C. | 水煤气是通过煤的液化得到的气态燃料 | |
| D. | 天然气是清洁燃料 |
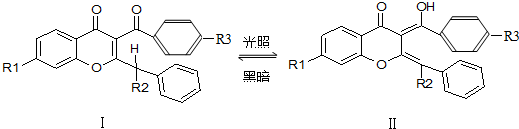
| A. | Ⅰ和Ⅱ互为同分异构体 | B. | Ⅱ可看作醇类 | ||
| C. | Ⅰ、Ⅱ均能发生加成反应 | D. | Ⅰ属于芳香烃 |
| A. | 给烧杯里的液体直接加热 | |
| B. | 将配制的NaOH溶液保存在配有玻璃塞的细口瓶中 | |
| C. | 用蒸发方法使KCl 从溶液中析出时,应将蒸发皿中KCl 溶液全部加热蒸干 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
 .
. 发生酯化反应的产物A是一种食用香料;11.6g甲完全燃烧可产生0.6mo1CO2和0.6mo 1H2O.相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基.
发生酯化反应的产物A是一种食用香料;11.6g甲完全燃烧可产生0.6mo1CO2和0.6mo 1H2O.相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基. 生成A的化学方程式为
生成A的化学方程式为  $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ .
.