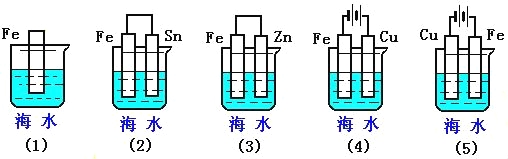
题目内容
【题目】(10分)反应aA(g)+bB(g)![]() cC(g) △H<0在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g) △H<0在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
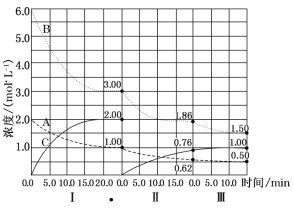
(1)反应的化学方程式中,a:b:c为_______;
(2)由第一次平衡到第二次平衡,改变的条件是__________;
(3) 由第二次平衡到第三次平衡,改变的条件是_________;
(4)第II阶段B的平衡转化率aII(B)=_______________;
(5)三次平衡时平衡常数KI、KII、KIII的大小顺序为_______________。
【答案】(10分,每题2分)(1)1:3:2 ;(2)将产物C全部取出(或将C的浓度减小到0);
(3)降温 ;(4)38%;(5)KIII>KI=KII(或KI=KII<KIII)
【解析】
试题分析:(1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,浓度变化量之比等于化学计量数之比,a:b:c=1mol/L:3mol/L:2mol/L=1:3:2;
(2)第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动;
(3)第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正反应方向为放热反应,可以推测为降低温度;
(4)根据图像可知αⅡ(B)=![]() ×100%=38%;
×100%=38%;
(5)平衡常数只与温度有关系,则根据以上分析可知由第二次平衡到第三次平衡,改变的条件是降低温度,平衡向正反应方向进行,所以三次平衡时平衡常数KI、KII、KIII的大小顺序为KIII>KI=KII。