��Ŀ����
����Ŀ���״����¡��״洢��ֵ�ߡ����ܻ���������ȼ�ϣ�������Ҫ�Ļ���ԭ�ϡ���ѧ����̫���ֽܷ�ˮ���ɵ������ڴ�����������![]() ��Ӧ���ɼ״�����֪��
��Ӧ���ɼ״�����֪��![]() ��
��![]() ��
��![]() ��ȼ����H�ֱ�Ϊ
��ȼ����H�ֱ�Ϊ![]() ��
��![]() ��
��![]() ����ش��������⣺
����ش��������⣺
(1)��̫���ֽܷ�![]() ˮ���ĵ�������________
ˮ���ĵ�������________![]() ��
��
(2)�״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ________��
(3)![]() ������ϳɼ״�(��Ӧ��)�а����ŷ�Ӧ��ķ�����
������ϳɼ״�(��Ӧ��)�а����ŷ�Ӧ��ķ�����
��Ӧ��![]()
��Ӧ��![]()
�ں�ѹ��![]() ��
��![]() ����ʼ��һ���������£�
����ʼ��һ���������£�![]() ƽ��ת���ʺ�ƽ��ʱ
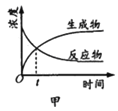
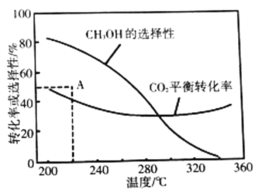
ƽ��ת���ʺ�ƽ��ʱ![]() ��ѡ�������¶ȵı仯��ͼ�����У�
��ѡ�������¶ȵı仯��ͼ�����У�![]() ��ѡ����
��ѡ����![]()
���¶ȸ���300�棬![]() ƽ��ת�������¶����߶�������ԭ����_________��
ƽ��ת�������¶����߶�������ԭ����_________��
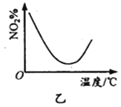
��220��ʱ���ڴ���������![]() ��
��![]() ��Ӧһ��ʱ����
��Ӧһ��ʱ����![]() ��ѡ����Ϊ48%(ͼ��A��)�����ı䷴Ӧʱ����¶ȣ�һ�������
��ѡ����Ϊ48%(ͼ��A��)�����ı䷴Ӧʱ����¶ȣ�һ�������![]() ѡ���ԵĴ�ʩ��_________________(д������)��
ѡ���ԵĴ�ʩ��_________________(д������)��
(4)�����Ϊ![]() ���ܱ������г���
���ܱ������г���![]() ��
��![]() ������Ӧ��ƽ��ʱ������ת����Ϊ25%����÷�Ӧ��ƽ�ⳣ��K=________��(���������λ��Ч����)
������Ӧ��ƽ��ʱ������ת����Ϊ25%����÷�Ӧ��ƽ�ⳣ��K=________��(���������λ��Ч����)
(5)�о�֤ʵ��![]() Ҳ����������Һ���ö��Ե缫������ɼ״������ɼ״��ĵ缫��ӦʽΪ__________����һ����������________________��
Ҳ����������Һ���ö��Ե缫������ɼ״������ɼ״��ĵ缫��ӦʽΪ__________����һ����������________________��
���𰸡�571.6 ![]() ��Ӧ���
��Ӧ���![]() ����Ӧ���
����Ӧ���![]() ���¶�����ʹ
���¶�����ʹ![]() ת��Ϊ
ת��Ϊ![]() ��ƽ��ת����������ʹ
��ƽ��ת����������ʹ![]() ת��Ϊ
ת��Ϊ![]() ��ƽ��ת�����½������������ȳ����½����� ����ѹǿ��ʹ�öԷ�Ӧ������Ը��ߵĴ��� 0.0062
��ƽ��ת�����½������������ȳ����½����� ����ѹǿ��ʹ�öԷ�Ӧ������Ը��ߵĴ��� 0.0062 ![]()
![]()
��������
��1��������ȼ���ȿ�֪ˮ�ֽ����յ�������Ȼ�����û�ѧ�������뷴Ӧ�ȵĹ�ϵ�����㣻
��2��CO��CH3OH��ȼ���ȸ�������д�ȷ���ʽ�������ø�˹�����������״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
��3���ٸ��������Ϣ����Ӧ����![]() ����Ӧ����
����Ӧ����![]() �������¶ȶԷ�Ӧ���ͷ�Ӧ����ƽ���ƶ�������ɣ�
�������¶ȶԷ�Ӧ���ͷ�Ӧ����ƽ���ƶ�������ɣ�
�ڸ���![]() ��ѡ����
��ѡ����![]() �Ķ��壬�¶Ȳ��ܸı䣬ֻ�ܸı�ѹǿ��Ũ�ȣ���������H2��Ũ�Ⱥ�����ѹǿ���Է�Ӧ���ͷ�Ӧ��ƽ���Ӱ�죬Ҳ��ͨ��������ѡ���������Ʒ�Ӧ���ͷ�Ӧ���ķ�����
�Ķ��壬�¶Ȳ��ܸı䣬ֻ�ܸı�ѹǿ��Ũ�ȣ���������H2��Ũ�Ⱥ�����ѹǿ���Է�Ӧ���ͷ�Ӧ��ƽ���Ӱ�죬Ҳ��ͨ��������ѡ���������Ʒ�Ӧ���ͷ�Ӧ���ķ�����
(4)���������Ϣ����������ʽ�����֪��![]()
 ������ƽ�ⳣ������ʽ����÷�Ӧ��ƽ�ⳣ����
������ƽ�ⳣ������ʽ����÷�Ӧ��ƽ�ⳣ����
(5)�����ù�����̼�Ļ��ϼ���+4�۽���Ϊ-2�۷�����ԭ��Ӧ�������ɼ״��������Ϸ������ҵ������������Һ������缫��ӦʽΪ![]() ����һ������������������������Ӧ���ʵ缫����ʽΪ��
����һ������������������������Ӧ���ʵ缫����ʽΪ��![]() ���ʵ�����ΪO2��
���ʵ�����ΪO2��
������1����H2��g����ȼ���ȡ�HΪ-285.8kJmol-1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ�����ֽ�1mol H2O��l��Ϊ1mol H2��g�����ĵ�����Ϊ285.8kJ����ֽ�2mol H2O��l�����ĵ�����Ϊ285.8kJ��2=571.6kJ���ʴ�Ϊ��571.6 kJ��
��2����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-283.0kJmol-1��-726.5kJmol-1����
��CO��g��+1/2O2��g��=CO2��g����H=-283.0kJmol-1
��CH3OH��l��+3/2O2��g��=CO2��g��+2H2O��l����
�ɸ�˹���ɿ�֪�â�-�ٵ÷�ӦCH3OH��l��+O2��g��=CO��g��+2 H2O��l�����÷�Ӧ�ķ�Ӧ����H=-726.5kJmol-1-��-283.0kJmol-1��=-443.5kJmol-1��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2 H2O��l����H=-443.5kJmol-1��
��3��������ɿ�֪����Ӧ����![]() �����¶�����ʹ
�����¶�����ʹ![]() ת��Ϊ
ת��Ϊ![]() ��ƽ��ת��������������Ӧ����
��ƽ��ת��������������Ӧ����![]() �����¶�����ʹ
�����¶�����ʹ![]() ת��Ϊ
ת��Ϊ![]() ��ƽ��ת�����½����������������ȳ����½����ȣ����յ���CO2��ƽ��ת�����������ʴ�Ϊ����Ӧ����
��ƽ��ת�����½����������������ȳ����½����ȣ����յ���CO2��ƽ��ת�����������ʴ�Ϊ����Ӧ����![]() ����Ӧ����
����Ӧ����![]() ���¶�����ʹ
���¶�����ʹ![]() ת��Ϊ
ת��Ϊ![]() ��ƽ��ת����������ʹ
��ƽ��ת����������ʹ![]() ת��Ϊ
ת��Ϊ![]() ��ƽ��ת�����½������������ȳ����½����ȣ�
��ƽ��ת�����½������������ȳ����½����ȣ�
�ڸ���![]() ��ѡ����
��ѡ����![]() �Ķ��壬�������ѡ���ԣ�Ӧ��ʹ��ƽ�������ɸ���CH3OH�ķ����ƶ����¶Ȳ��ܸı䣬ֻ�ܸı�ѹǿ��Ũ�ȣ�������H2��Ũ�ȣ���Ӧ��Ҳ�������ƶ�����CH3OH��ѡ���Բ�һ����ߣ���������ѹǿ����Ӧ��ƽ�ⲻ�ƶ�����Ӧ��ƽ�������ƶ�����CH3OH��ѡ����һ����ߣ�ͬʱҲ��ͨ���ı���������Ʒ�Ӧ���ͷ�Ӧ���ķ�����Ѱ��һ�ֶԷ�Ӧ�������Ը��ߵĴ����������ѡ���ԣ��ʴ�Ϊ������ѹǿ��ʹ�öԷ�Ӧ�������Ը��ߵĴ�����
�Ķ��壬�������ѡ���ԣ�Ӧ��ʹ��ƽ�������ɸ���CH3OH�ķ����ƶ����¶Ȳ��ܸı䣬ֻ�ܸı�ѹǿ��Ũ�ȣ�������H2��Ũ�ȣ���Ӧ��Ҳ�������ƶ�����CH3OH��ѡ���Բ�һ����ߣ���������ѹǿ����Ӧ��ƽ�ⲻ�ƶ�����Ӧ��ƽ�������ƶ�����CH3OH��ѡ����һ����ߣ�ͬʱҲ��ͨ���ı���������Ʒ�Ӧ���ͷ�Ӧ���ķ�����Ѱ��һ�ֶԷ�Ӧ�������Ը��ߵĴ����������ѡ���ԣ��ʴ�Ϊ������ѹǿ��ʹ�öԷ�Ӧ�������Ը��ߵĴ�����
(4)�����Ϊ![]() ���ܱ������г���
���ܱ������г���![]() ��
��![]() ������Ӧ������ƽ��ʱ������ת����Ϊ25%����������ʽ�����֪��
������Ӧ������ƽ��ʱ������ת����Ϊ25%����������ʽ�����֪��![]()
 ���÷�Ӧ��ƽ�ⳣ��
���÷�Ӧ��ƽ�ⳣ�� ���ʴ�Ϊ��0.0062��
���ʴ�Ϊ��0.0062��
(5)�о�֤ʵ��![]() Ҳ����������Һ���ö��Ե缫������ɼ״����ù�����̼�Ļ��ϼ���+4�۽���Ϊ-2�۷�����ԭ��Ӧ�������ɼ״��������Ϸ������ҵ������������Һ������缫��ӦʽΪ
Ҳ����������Һ���ö��Ե缫������ɼ״����ù�����̼�Ļ��ϼ���+4�۽���Ϊ-2�۷�����ԭ��Ӧ�������ɼ״��������Ϸ������ҵ������������Һ������缫��ӦʽΪ![]() ����һ������������������������Ӧ���ʵ缫����ʽΪ��
����һ������������������������Ӧ���ʵ缫����ʽΪ��![]() ���ʵ�����ΪO2���ʴ�Ϊ��
���ʵ�����ΪO2���ʴ�Ϊ��![]() ��O2��
��O2��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�