题目内容
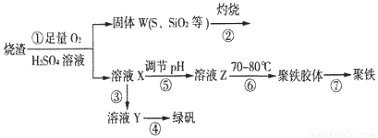
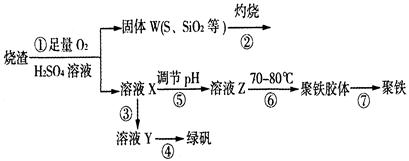
绿矾(FeSO4·7H2O)是治疗缺铁性盆血药品的重要成分.实验室利用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备绿矾的过程如下:

(1)固体W焙烧时产生某有毒气体,需以碱液吸收处理之,下列装置A~D中可选用________(填字母);若选用E装置,则烧杯中的下层液体可以是________(填名称).

(2)实验过程中多次使用过滤操作.过滤操作中用到的玻璃仪器有________.
(3)写出溶液X中加铁屑发生反应的离子方程式________.
(4)测定绿矾产品中Fe2+含量的实验步骤:
a.称取5.7 g绿矾产品,溶解,在250 mL容量瓶中定容;
b.量取25 mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40 mL(滴定时发生反应的离子方程式为:5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O)
+8H+=5Fe3++Mn2++4H2O)
①计算上述产品中FeSO4·7H2O的质量分数为________.
②若用上述方法测定的产品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有(只回答一条即可)________.

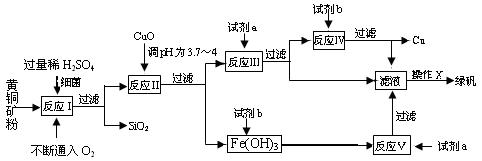
(10分) 以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
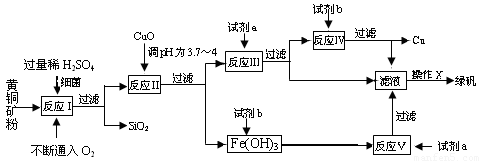
已知:①4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表:
|
沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀pH |
4.7 |
2.7 |
7.6 |
|
完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)试剂a是___________,试剂b是_____________。
(2)操作X应为蒸发浓缩、________________、________________。
(3)反应Ⅱ中加CuO调pH为3.7~4的目的是
。
(4)反应Ⅴ的离子方程式为___________________________。

 H如下表:
H如下表:
 中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。 加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)