题目内容
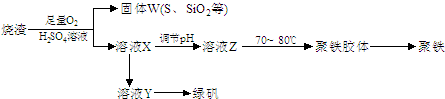
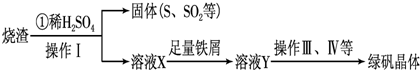
(14分)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
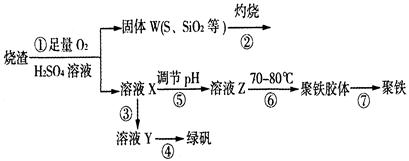
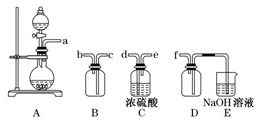
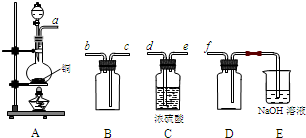
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有
;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.00g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为2.33g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
(1)ACD(2分)
(2)4FeS + 3O2 + 6H2SO4 = 2Fe2(SO4)3 + 6H2O + 4S (2分)
(3)Fe(或铁)(2分) (4)蒸发皿、玻璃棒(2分) (5)C (2分)
(6)促进Fe3+的水解(2分) (7)28.0%(2分)
【解析】
试题分析:(1)过程②产生的气体为SO2,因此能褪色的溶液由品红溶液、高锰酸钾溶液、溴水。故答案为ACD。
(2)该反应的化学方程式为:4FeS+3O2 +6H2SO4=2Fe2(SO4)3+6H2O+4S
(3)过程③主要是将铁离子还原为亚铁离子,因此应加入还原铁粉。
(4)蒸发结晶所需要的仪器有酒精灯、三角架、泥三角、蒸发皿、玻璃棒。
(5)溶液X为酸性溶液,故调节pH时应用碱性溶液,答案为C。
(6)升高温度,可以促进铁离子的水解。
(7)可得关系式: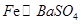 ,由于所得沉淀为2.33g,因此铁元素的质量为0.56g。则铁元素的质量分数为
,由于所得沉淀为2.33g,因此铁元素的质量为0.56g。则铁元素的质量分数为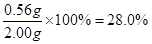 。
。
考点:铁及其化合物;质量分数的计算;
点评:本题是对无机化合物的综合考查,属于中等难度题。解题时,应注意相关物质的化学性质,另外对于流程图的分析需明确每一步反应后溶液的成分。对于计算题,应充分利用质量守恒定律,从而简化计算量。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案