题目内容
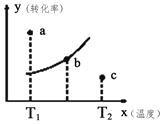
【题目】如图表示800℃时,X、Y、Z三种气体物质的浓度随时间变化的情况.试回答:(保留一位小数)
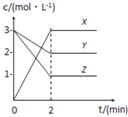
(1)该反应的反应物为 ______ ;
(2)该反应的化学方程式为 ______ ;
(3)0~2minY物质的化学反应速率为 ______ ;
(4)Z物质的平衡转化率为 ______ ;
(5)800℃时,该反应的平衡常数K= ______ .
【答案】Y、Z Y+2Z3X 0.5mol/(Lmin) 66.67% 13.5
【解析】
(1)反应物在反应中浓度降低;
(2)根据物质浓度的变化量确定化学方程式;
(3)根据公式![]() 计算化学反应速率;
计算化学反应速率;
(4)利用Z转化的浓度与起始浓度的比值确定Z的转化率;
(5)先判断出平衡时三种物质的浓度,再代入化学平衡常数表达式计算化学平衡常数。
(1)反应物在反应中浓度降低,根据图象中曲线变化可知Y、Z浓度降低,X浓度增大,则Y、Z为反应物,X为生成物;
故答案为Y、Z;
(2)Y浓度减小了(32)mol/L=1mol/L,Z浓度减小了(31)mol/L=2mol/L,X浓度增大了3mol/L,故化学计量数之比为1:2:3,则化学方程式为:Y+2Z3X;
故答案为:Y+2Z3X;
(3)02minY物质的浓度减小了1mol/L,其化学反应速率为![]() ;
;
故答案为:0.5mol/(Lmin);
(4)Z浓度减小了2mol/L,Z起始浓度为3mol/L,则Z的转化率为:![]() ;
;
故答案为:66.67%;
(5)平衡时,Y浓度为2mol/L,Z浓度为1mol/L,X浓度为3mol/L,则 ;
;
故答案为:13.5。

练习册系列答案
相关题目