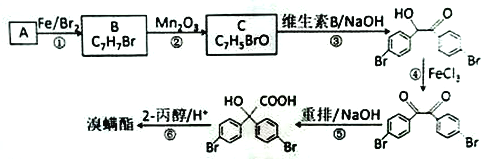
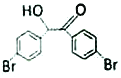
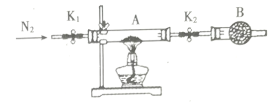
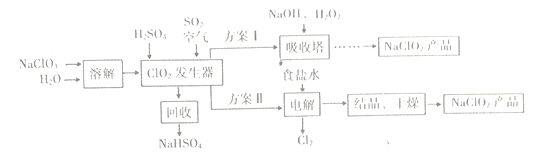
题目内容
【题目】实验测得常温下0.1mol/L某一元酸HA溶液的pH≠1,0.1mol/L某一元碱BOH溶液里![]() 。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
A.c (A-)>c (B+)>c (H+)>c (OH-)
B.c (B+)=c (A-)>c (H+)=c (OH-)
C.c (OH-)- c (H+)=c(HA)
D.c (B+)+ c (H+)=c (A-)+c (OH-) + c(HA)
【答案】C
【解析】
试题分析:常温下0.1mol/L某一元酸HA溶液的pH≠1,说明HA是弱酸,在溶液中存在电离平衡:HA![]() H++A-,0.1mol/L某一元碱BOH溶液里
H++A-,0.1mol/L某一元碱BOH溶液里![]() ,由于Kw=1×10-14,所以c (OH-)=0.1mol/L,因此BOH是一元强碱。将此两种溶液等体积混合后,二者恰好完全反应产生强碱弱酸盐BA。A.根据物料守恒可知c (B+)= c (A-)+c(HA),所以c (B+)>c (A-),由于A-水解,消耗水电离产生的H+,所以溶液达到平衡时c (OH-)>c (H+),盐水解程度是微弱的,主要以盐电离产生的离子存在,故溶液中离子浓度大小关系是c (B+)>c (A-)>c (OH-) >c (H+),错误;B. 由于HA是弱酸,A-会发生水解反应,所以c (B+)>c (A-),水解消耗H+,所以c (OH-)>c (H+),错误;C.根据质子守恒可知c (OH-) =c (H+)+c(HA) ,所以c (OH-)- c (H+)=c(HA),正确;D.根据电荷守恒可知 c (B+)+ c (H+)=c (A-)+c (OH-) ,错误。
,由于Kw=1×10-14,所以c (OH-)=0.1mol/L,因此BOH是一元强碱。将此两种溶液等体积混合后,二者恰好完全反应产生强碱弱酸盐BA。A.根据物料守恒可知c (B+)= c (A-)+c(HA),所以c (B+)>c (A-),由于A-水解,消耗水电离产生的H+,所以溶液达到平衡时c (OH-)>c (H+),盐水解程度是微弱的,主要以盐电离产生的离子存在,故溶液中离子浓度大小关系是c (B+)>c (A-)>c (OH-) >c (H+),错误;B. 由于HA是弱酸,A-会发生水解反应,所以c (B+)>c (A-),水解消耗H+,所以c (OH-)>c (H+),错误;C.根据质子守恒可知c (OH-) =c (H+)+c(HA) ,所以c (OH-)- c (H+)=c(HA),正确;D.根据电荷守恒可知 c (B+)+ c (H+)=c (A-)+c (OH-) ,错误。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目