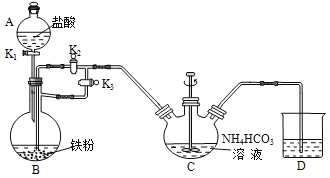
��Ŀ����
����Ŀ�� CO2����Դ������һֱ�ǻ�ѧ���ǹ�ע����Ҫ���⣬�п�Ժ������ѧ�����о��������һ�����Ͷ�ܸ��ϴ������ɹ���ʵ����CO2ֱ�Ӽ�����ȡ������ֵ���ͣ�![]() (��Ӧ��)�����о��ɹ�������Ϊ��CO2��ת�������ͻ���Խ�չ����
(��Ӧ��)�����о��ɹ�������Ϊ��CO2��ת�������ͻ���Խ�չ����
(1)��֪������ȼ����Ϊ![]() ����Ҫ����
����Ҫ����![]() ��ȼ������a��ֵ������Ҫ֪��һ����Ӧ��
��ȼ������a��ֵ������Ҫ֪��һ����Ӧ��![]() ���÷�Ӧ��________________________________����Ӧ����һ�������¾����Է��ԣ���a_______________0(����>������<��)��
���÷�Ӧ��________________________________����Ӧ����һ�������¾����Է��ԣ���a_______________0(����>������<��)��
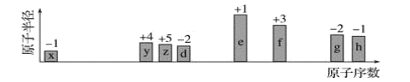
(2)��ij�ܱ������а�һ��Ͷ�ϱȳ���![]() ��
��![]() ����������ʹ�䷢����Ӧ��
����������ʹ�䷢����Ӧ��![]() �����
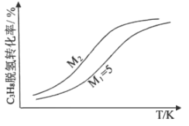
�����![]() ��ƽ��ת�������¶ȡ�ѹǿ֮��Ĺ�ϵ��ͼ1��ʾ��
��ƽ��ת�������¶ȡ�ѹǿ֮��Ĺ�ϵ��ͼ1��ʾ��
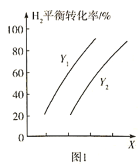
��X��ʾ______________��![]() ___________
___________![]() (����>������<��)�������
(����>������<��)�������![]() ��ƽ��ת���ʲ���ߵ�λʱ����
��ƽ��ת���ʲ���ߵ�λʱ����![]() �IJ������ɲ�ȡ�Ĵ�ʩ��______________________(������)��
�IJ������ɲ�ȡ�Ĵ�ʩ��______________________(������)��
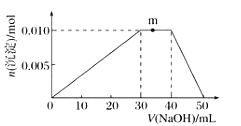
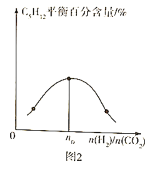
(3)����һ���¶ȡ�����������ͬͶ�ϱ�![]() ����Ӧ��ͨ�뵽ij�ܱ������У����ƽ��ʱ
����Ӧ��ͨ�뵽ij�ܱ������У����ƽ��ʱ![]() �İٷֺ�����Ͷ�ϱ�֮��Ĺ�ϵ��ͼ2��ʾ����
�İٷֺ�����Ͷ�ϱ�֮��Ĺ�ϵ��ͼ2��ʾ����![]() ____________��
____________��
(4)����-��˫���������������£�CH3OH��CO2��H2�ɸ�Ч��ת��Ϊ���ᣬ��Ӧ����ʽΪ![]() ��һ���¶��£���ij����������ͨ������ʵ���������ԭ�����������ϵ�е���ѹǿ��ʱ��Ĺ�ϵ���±���ʾ��
��һ���¶��£���ij����������ͨ������ʵ���������ԭ�����������ϵ�е���ѹǿ��ʱ��Ĺ�ϵ���±���ʾ��
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
p/kPa | 3 | 2.7 | 2.5 | 2.35 | 2.26 | 2.2 | 2.2 |
��Ӧ��ʼ���ﵽƽ��Ĺ����У�![]() ______________
______________![]() ______________
______________![]() ��
��
(5)̼�������ķ�չҲ������CO2����ԴӦ�÷���õ�������á������£���ij����NaOH��Һ�������е�CO2������Һ��pH=10���������Һ��![]() ����
����![]() _____________
_____________![]() ��
��
���𰸡�![]() < ѹǿ < ����ѹǿ������
< ѹǿ < ����ѹǿ������![]() 3.2 0.032 80
3.2 0.032 80 ![]()
��������
(1)���ݸ�˹���ɷ���������G=��H-T��S<0ʱ��Ӧ�����Է����У�
(2)�÷�ӦΪ���ȷ�Ӧ����XΪ�¶ȣ����¶�����ƽ�������ƶ���������ת����Ӧ��С����ͼ�β���������XΪѹǿ��YΪ�¶ȣ�
(4)���������У�����ķ�ѹ֮�ȵ������ʵ���֮�ȣ����Կ���ѹǿ��ЧΪ���ʵ��������м��㣬���Բ������ʼͶ��ΪCH3OH��CO2��H2��Ϊ1mol����ƽ��ʱ����������ʵ���Ϊ2.2mol����ƽ��ʱ�������ʵ�ת����Ϊx����������ʽ��
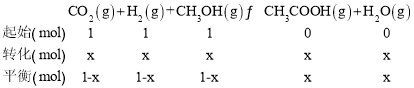
����3(1-x)+2x=2.2mol�����x=0.8mol��
(1)��ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪH2(g)+![]() O2(g)=H2O(l)��H �ڣ�
O2(g)=H2O(l)��H �ڣ�
����֪��Ӧ![]() �٣�
�٣�
��-����16�ɵ÷�Ӧ![]() �����ݸ�˹��֪����֪���÷�Ӧ���ʱ䣬������Ӧ�ٵ��ʱ䣻����G=��H-T��S<0ʱ��Ӧ�����Է����У��÷�ӦΪ������ٵķ�Ӧ�����ԡ�S<0����Ҫ�����H-T��S<0���H����С��0��
�����ݸ�˹��֪����֪���÷�Ӧ���ʱ䣬������Ӧ�ٵ��ʱ䣻����G=��H-T��S<0ʱ��Ӧ�����Է����У��÷�ӦΪ������ٵķ�Ӧ�����ԡ�S<0����Ҫ�����H-T��S<0���H����С��0��
(2)���ݷ�����֪X��ʾѹǿ��Y��ʾ�¶ȣ���ͬѹǿ�£��¶�Խ��������ת����ԽС������Y1<Y2�����������̼��Ũ�ȿ���ʹƽ�������ƶ����ҷ�Ӧ��������λʱ����C5H12(l)�IJ������÷�ӦΪ���������С�ķ�Ӧ����С�������ѹǿҲ����ʹƽ�������ƶ���ͬʱ����Ӧ���ʣ������¶ȡ���ʱ������������Ȼ��ʹƽ�������ƶ�������ʹ��Ӧ���ʼ�С�������������Բ�ȡ�Ĵ�ʩ������ѹǿ������![]() ��
��
(3)���ڿ��淴Ӧ������Ӧ���Ͷ�ϱ��������֮�����ʱ�������ƽ��ٷֺ����������n0=![]() =3.2��
=3.2��
(4)���ݱ������ݿ�֪25minʱ��Ӧ�ﵽƽ�⣬��Ϸ�����֪��ʱ���ڡ�p(CO2)=0.8kPa������v(CO2)=![]() =0.032kPa/min����Ϸ�����֪ƽ��ʱp(CO2)= p(CH3OH)= p(H2)=0.2kPa��p(H2O)= p(CH3COOH)=0.8kPa������Kp=
=0.032kPa/min����Ϸ�����֪ƽ��ʱp(CO2)= p(CH3OH)= p(H2)=0.2kPa��p(H2O)= p(CH3COOH)=0.8kPa������Kp=![]() =80kPa-1��
=80kPa-1��
(5)Ka2(H2CO3)=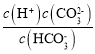 ��
��![]() ʱ��pH=10����c(H+)=10-10mol/L������Ka2(H2CO3)=0.5��10-10=5��10-11��
ʱ��pH=10����c(H+)=10-10mol/L������Ka2(H2CO3)=0.5��10-10=5��10-11��

����Ŀ����֪25 ��ʱ0.1 mol��L��1������Һ��pHԼΪ3�������м�������ƾ��壬�Ⱦ����ܽ������Һ��pH�����������������ֲ�ͬ�Ľ��ͣ���ͬѧ��Ϊ������ˮ��ʼ��ԣ�������c(OH��)�������Һ��pH������ͬѧ��Ϊ����������ˮ�����������������ӣ������˴���ĵ��룬ʹc(H��)��С�������Һ��pH����
(1)�������ֽ�����________(����������������)��ȷ��
(2)Ϊ����֤�������ֽ�����ȷ������������ʵ�飺��0.1 mol��L��1�Ĵ�����Һ�м����������������е�________(��д�����ĸ)��Ȼ��ⶨ��Һ��pH��
A������CH3COOK | B������CH3COONH4 |
C������NH3 | D������NaHCO3 |
(3)��________(����������������)�Ľ�����ȷ����Һ��pHӦ________(����������������С������������)(��֪25 �� ʱ��CH3COONH4��Һ������)��
(4)�����½�0.010 mol CH3COONa��0.004 mol HCl����ˮ�����Ƴ�0.5 L�����Һ���жϣ�
����Һ�й���________�����ӡ�
����Һ�����������ӵ����ʵ����ĺ�һ������0.010 mol��������________��________��
����Һ��n(CH3COO��)��n(OH��)��n(H��)��________mol��