题目内容
【题目】I.氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A 和B。A 为铵盐,B 在标准状况下为气态。在此反应中,若每有1体积氨气参加反应,同时有0.75 体积氟气参加反应;若每有8.96L 氨气(标准状况)参加反应,同时生成0.3 mol A。
(1) 写出氨气和氟气反应的化学方程式_____________________________________________________。
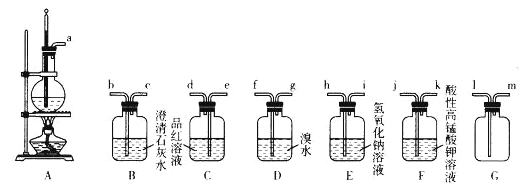
Ⅱ.某固体可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现取该固体进行如下实验,所得现象和有关数据如下所示(气体体积的数据均已折算成标准状况下):

请回答下列问题:
(2)混合物中存在的物质有____________________(填化学式)。
Ⅲ.(3)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41 g 硫酸铜晶体,在坩埚中加热至质量不再改变时,称量粉末的质量为1.6 g。则计算得x=____(计算结果精确到0.1)。
Ⅳ.称取3.60 g草酸亚铁晶体(FeC2O4·2H2O),用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如下图所示。

(4) 分析图中数据,写出过程Ⅰ发生反应的化学方程式______________。
(5) 300 ℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式______________________。
【答案】4NH3+3F2![]() 3NH4F+NF3 MgCl2、Al、(NH4)2SO4 4.5 FeC2O4·2H2O
3NH4F+NF3 MgCl2、Al、(NH4)2SO4 4.5 FeC2O4·2H2O![]() FeC2O4+2H2O Fe2O3
FeC2O4+2H2O Fe2O3
【解析】
(1)氨气和氟气反应生成A和B,其中A为铵盐,即A为NH4F,每消耗1体积氨气,同时消耗0.75体积的F2,即NH3和F2系数分别为4、3,8.96L氨气的物质的量为0.4mol,即0.4molNH3参与反应,生成0.3molA,NH3和A的系数分别为4、3,即4NH3+3F2→3NH4F+B,根据原子守恒,推出B的化学式为NF3,化学方程式为4NH3+3F2![]() 3NH4F+NF3;
3NH4F+NF3;
答案为4NH3+3F2![]() 3NH4F+NF3;
3NH4F+NF3;
(2)固体与过量NaOH发生反应,生成11.2L气体(0.5mol),该气体通过碱石灰,气体体积不变,通过浓硫酸气体体积为6.72L(0.3mol),推出固体与NaOH反应生成的气体为H2、NH3,固体中含有Al、(NH4)2SO4;固体与过量的NaOH浓溶液反应生成5.80g白色沉淀,久置无明显变化,因此固体中不含FeCl2,因为所加NaOH为过量,因此5.80g白色沉淀为Mg(OH)2,即固体中含有MgCl2;Al与过量的NaOH溶液反应生成NaAlO2和H2,无色溶液为含有NaAlO2,加入稀盐酸,发生AlO2-+H++H2O=Al(OH)3↓,继续加盐酸,发生Al(OH)3+3H+=Al3++3H2O,因此无法推出固体中是否含有AlCl3,综上所述,固体一定存在物质是Al、(NH4)2SO4、MgCl2;
答案为Al、(NH4)2SO4、MgCl2;
(3)固体质量减少等于水的质量,即水的质量为m(H2O)=(2.41g-1.6g)=0.081g,加热后粉末为CuSO4,n(CuSO4)=![]() =0.01mol,因此有
=0.01mol,因此有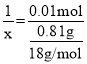 ,解得x=4.5;
,解得x=4.5;
答案为4.5;
(4)过程I应是失去结晶水的过程,3.60g草酸亚铁晶体中所含结晶水的质量为![]() ×100%=0.72g,过程I失去结晶水的质量为(3.60g-2.88g)=0.72g,过程I失去了全部结晶水,化学反应方程式为FeC2O4·2H2O
×100%=0.72g,过程I失去结晶水的质量为(3.60g-2.88g)=0.72g,过程I失去了全部结晶水,化学反应方程式为FeC2O4·2H2O ![]() FeC2O4+2H2O;
FeC2O4+2H2O;
答案为FeC2O4·2H2O ![]() FeC2O4+2H2O;
FeC2O4+2H2O;
(5)草酸亚铁晶体中铁元素的质量为![]() =1.12g,铁原子的物质的量为
=1.12g,铁原子的物质的量为![]() =0.02mol,铁的氧化物中氧元素的质量为(1.60-1. 12)g=0.48g,氧原子物质的量为
=0.02mol,铁的氧化物中氧元素的质量为(1.60-1. 12)g=0.48g,氧原子物质的量为![]() =0.03mol,铁氧化物中铁原子和氧原子物质的量之比为0.02:0.03=2:3,即铁的氧化物是Fe2O3;
=0.03mol,铁氧化物中铁原子和氧原子物质的量之比为0.02:0.03=2:3,即铁的氧化物是Fe2O3;
答案为Fe2O3.