题目内容
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸):
请回答下列问题:
(1)C,N,O的第一电离能由大到小的顺序为 。
(2)写出基态Cu+的核外电子排布式 。
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为 。
(4)写出与CO互为等电子体的离子 。(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子和N原子轨道的杂化类型分别为 ;1 mol尿素分子中,σ键的数目为 。
(1)N>O>C (2)[Ar]3d10(3)4 (4)CN-(5)sp2杂化、sp3杂化;4.214×1024
解析试题分析:(1)一般来说非金属性越强,第一电离能大,所以O>N>C,但是因为p轨道半充满体系具有很强的稳定性,N的p轨道本来就是半充满的,O的p轨道失去一个电子才是半充满的,所以O比N容易失去电子,故答案为N>O>C(2)铜原子的核外电子排布为1s22s22p63s23p63d104s1 故一价铜离子的核外电子排布为1s22s22p63s23p63d10,故答案为[Ar]3d10(3)一价铜离子有三个氨基配体和一个羰基配体,共4个配体,故答案为4(4)等电子体为核外电子数相同的粒子,羰基为14个电子,如CN-也为14个电子,故答案为CN-(5)中心原子为碳,价电子数为4,氧不为中心原子,不提供电子,每个亚氨基提供一个电子,电子对数为(4+1×2)÷2=3,故杂化轨道为sp2,中心原子为氮,氮原子含有3个共价键和一个孤电子对氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3;σ键的数目为3,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为 7NA故答案为sp2、sp3;7NA。
考点:物质的结构与性质之间的关系;元素电离能、电负性的含义及应用;原子轨道杂化方式及杂化类型判断

 轻松暑假总复习系列答案
轻松暑假总复习系列答案根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是 ( )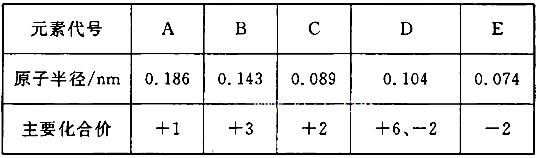
| A.E2-与B3+的核外电子数不可能相等 |
| B.离子半径大小A+<E2- |
| C.最高价氧化物对应水化物的碱性A<C |
| D.氢化物的稳定性H2D>H2E |
2013年12月2日“嫦娥三号”进行首次月球软着陆,它携带的核能电池又称放射性同位素发电装置。下列有关简单原子的原子结构①②③的叙述正确的是(其中 表示质子,
表示质子, 表示中子,
表示中子, 表示电子)
表示电子)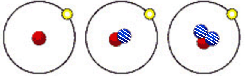
① ② ③
| A.①②③都是由质子、中子、电子组成的 |
| B.①②③都为氢元素的一种核素 |
| C.①②③具有相同的质量数 |
| D.①②③是三种化学性质完全不同的粒子 |
下列有关钛原子(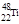 )的说法正确的是:
)的说法正确的是:
| A.质子数为48 | B.中子数为48 | C.质量数为22 | D.原子序数为22 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/10-12 m | 160 | 110 | 70 | 66 |
| 主要化合价 | +2 | +5、+3、-3 | +5、+3、-3 | -2 |
下列叙述正确的是( )
A.离子半径:W2-<X2+
B.气态氢化物的稳定性:Z>W
C.化合物X3Z2中既含有离子键又含有共价键
D.最高价氧化物对应水化物的酸性:Z>Y
下列说法正确的是( )
| A.氘原子中的质子数和中子数之比为1∶1 |
| B.Na2O2、Na2O中均只含离子键 |
| C.NH4Cl属于离子化合物,不含共价键 |
| D.18 g重水(D2O)中含有的电子数为10 NA |
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
| | | R | |
| T | Q | | W |
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
X、Y、Z是三种短周期的主族元素,在周期表中的位置如图所示,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
| A.原子半径:Y>Z>X |
| B.气态氢化物的热稳定性:X<Z |
| C.Y和Z的最高价氧化物对应水化物均为强酸 |
| D.若Z的最高正价为+m,则X的最高正价也一定为+m |