题目内容
(6分,每空格3分。少选得1分,多选为0分)
(1)下列方法可以证明2HI(g)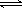 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成nmolH2的同时生成nmolHI;
②一个H-H 键断裂的同时有两个H-I键断裂;
③反应速率v(H2)=v(I2)=0.5v(HI)时;
④C(HI)=c(H2)=c(I2)=2:1:1且保持不变;
⑤温度和体积一定时,某一生成物浓度不再变化;
⑥温度和体积一定时,容器内压强不再变化;
⑦温度和压强一定时混合气体密度不再变化
(2)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)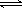 2SO3(g)。研究发现,
2SO3(g)。研究发现,
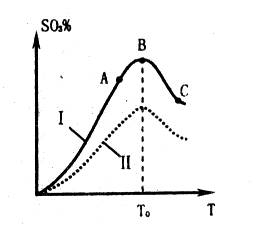
SO3的体积分数(SO3%)随温度(T)的变化如上图所示。
下列判断正确的是
A. 该反应的正反应为放热反应
B. 曲线I上A、C两点反应速率的关系是:VA>VC
C. 反应达到B点时,2V正(O2)=V逆(SO3)
D. 已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化剂的曲线,则II是Fe2O3作催化剂的曲线
(1)②④⑤ (2)AC
【解析】(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以④⑤可以。①中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不正确。②中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。速率之比是相应的化学计量数之比,因此③中的关系始终是成立,不正确。反应前后体积不变,因此压强始终是不变的,⑥不正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,⑦不正确。答案选②④⑤。
(2)根据图像可知,当三氧化硫的含量达到最高时,说明达到平衡状态,C正确。升高温度,含量是降低的。说明升高温度平衡向逆反应方向移动,即正反应是放热反应,A正确。C点的温度高,反应速率大,B不正确。催化剂不能改变平衡状态,所以平衡时三氧化硫的含量是不变的,D不正确,答案选AC。

(16分。每空格2分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序 。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”)
理由是
|
元素 |
Mn |
F |
|
|
电离能 ( |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
a |
b |
(4)AC2分子中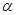 键和
键和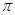 键数目比为
;
键数目比为
;
AC2分子中A原子的杂化方式是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
H2S |
187 |
202 |
2.6 |
|
H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是:
①熔点、沸点差异的主要原因
②在水中的溶解度差异的主要原因
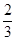 。该绿色晶体配合物的化学式为
。该绿色晶体配合物的化学式为  H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是 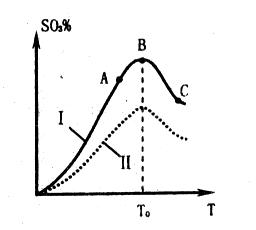
 )
)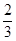 。该绿色晶体配合物的化学式为
。该绿色晶体配合物的化学式为