题目内容
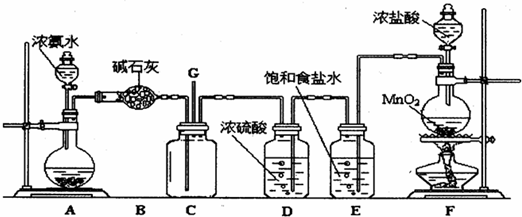
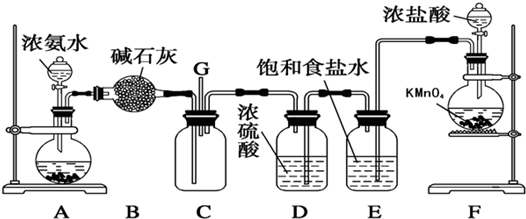
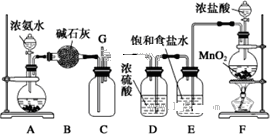
某学生利用以下装置探究纯净干燥的氯气与氨气之间的反应.

回答下列问题:
(1)根据下列所给试剂,选择制取氨气的装置是(填对应字母)
二氧化锰、碱石灰、浓盐酸、浓氨水、烧碱、生石灰
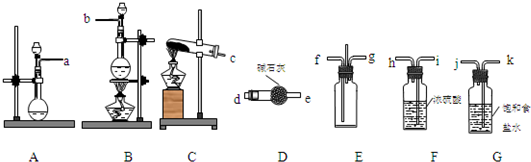
(2)已知,E装置是用于使纯净干燥的氯气与氨气发生反应的装置,试说明该装置的设计意图:
(3)根据实验目的,所选装置的连接顺序为(填装置的接口字母):
(4)氯气和氨气在常温下相混合就会发生反应生成氯化铵和氮气,该反应的化学方程式为:
(5)请你评价此套装置有何缺点

回答下列问题:
(1)根据下列所给试剂,选择制取氨气的装置是(填对应字母)
A
A
;写出制备氯气的离子反应方程式MnO2+4H++2C1-
Mn2++C12↑+2H2O
| ||
MnO2+4H++2C1-
Mn2++C12↑+2H2O
.
| ||
二氧化锰、碱石灰、浓盐酸、浓氨水、烧碱、生石灰
(2)已知,E装置是用于使纯净干燥的氯气与氨气发生反应的装置,试说明该装置的设计意图:
将比空气轻的氨气从长管口f进入,比空气重的氯气从短管口g进入,使反应气体逆流接触充分反应,中间导管用于排出空气以减少内部压力
将比空气轻的氨气从长管口f进入,比空气重的氯气从短管口g进入,使反应气体逆流接触充分反应,中间导管用于排出空气以减少内部压力
.(3)根据实验目的,所选装置的连接顺序为(填装置的接口字母):
a
a
接d
d
,e
e
接( f ),( g )接h
h
,i
i
接j
j
,k
k
接b
b
;其中,G装置的作用是除去C12中的HCl气体
除去C12中的HCl气体
.(4)氯气和氨气在常温下相混合就会发生反应生成氯化铵和氮气,该反应的化学方程式为:
3C12+8NH3=6NH4Cl+N2
3C12+8NH3=6NH4Cl+N2
;其中,氧化剂与还原剂的物质的量之比是3:2
3:2
.(5)请你评价此套装置有何缺点
缺少尾气处理装置,造成空气污染
缺少尾气处理装置,造成空气污染
.分析:(1)根据提供的药品,应用浓氨水和碱石灰或生石灰反应制备氨气,可用A装置,实验室用二氧化锰和浓盐酸反应制备氯气;
(2)由于氨气的密度小,氯气的密度大,密度小氨气的从长管进入向上扩散,密度大的氯气从短管进入向下扩散,这样能较快的充分的混合;
(3)装置A制取氨气,可用浓氨水与碱石灰(或烧碱或生石灰等),B装置中盛放的碱石灰,用来干燥氨气;G装置中盛放的饱和食盐水,用来除去氯气中混有的氯化氢气体;根据气体的制备、除杂、混合反应的顺序安装反应装置;
(4)氯气和氨气在常温下相混合就会发生反应生成氯化铵和氮气,反应的化学方程式为3C12+8NH3=6NH4Cl+N2,根据化合价的变化判断氧化剂和还原剂的物质的量之比;
(5)氯气和氨气都污染空气,不能直接排放到空气中,应有尾气处理装置.
(2)由于氨气的密度小,氯气的密度大,密度小氨气的从长管进入向上扩散,密度大的氯气从短管进入向下扩散,这样能较快的充分的混合;
(3)装置A制取氨气,可用浓氨水与碱石灰(或烧碱或生石灰等),B装置中盛放的碱石灰,用来干燥氨气;G装置中盛放的饱和食盐水,用来除去氯气中混有的氯化氢气体;根据气体的制备、除杂、混合反应的顺序安装反应装置;
(4)氯气和氨气在常温下相混合就会发生反应生成氯化铵和氮气,反应的化学方程式为3C12+8NH3=6NH4Cl+N2,根据化合价的变化判断氧化剂和还原剂的物质的量之比;
(5)氯气和氨气都污染空气,不能直接排放到空气中,应有尾气处理装置.
解答:解:(1)根据提供的药品,应用浓氨水和碱石灰或生石灰反应制备氨气,可用A装置,实验室用二氧化锰和浓盐酸反应制备氯气,反应的离子方程式
为MnO2+4H++2C1-
Mn2++C12↑+2H2O,故答案为:A; MnO2+4H++2C1-
Mn2++C12↑+2H2O;
(2)由于氨气的密度小,氯气的密度大,密度小氨气的从长管进入向上扩散,密度大的氯气从短管进入向下扩散,这样能较快的充分的混合,具体操作为将比空气轻的氨气从长管口f进入,比空气重的氯气从短管口g进入,使反应气体逆流接触充分反应,中间导管用于排出空气以减少内部压力,
故答案为:将比空气轻的氨气从长管口f进入,比空气重的氯气从短管口g进入,使反应气体逆流接触充分反应,中间导管用于排出空气以减少内部压力;
(3)装置A制取氨气,可用浓氨水与碱石灰(或烧碱或生石灰等),B装置中盛放的碱石灰,用来干燥氨气;G装置中盛放的饱和食盐水,用来除去氯气中混有的氯化氢气体;F装置用来干燥氯气,然后在E中混合反应,则连接顺序为a接d,e接f,g接h,i接j,k接b,
故答案为:a;d;e;h;i;j;k;b;除去C12中的HCl气体;
(4)氯气和氨气在常温下相混合就会发生反应生成氯化铵和氮气,反应的化学方程式为3C12+8NH3=6NH4Cl+N2,由化合价的变化可以看出,当3mol氯气参加反应时,有2mol氨气被氧化,所以氧化剂和还原剂的物质的量之比为3:2,
故答案为:3C12+8NH3=6NH4Cl+N2;3:2;
(5)氯气和氨气都污染空气,不能直接排放到空气中,实验缺少尾气处理装置,
故答案为:缺少尾气处理装置,造成空气污染.
为MnO2+4H++2C1-
| ||
| ||
(2)由于氨气的密度小,氯气的密度大,密度小氨气的从长管进入向上扩散,密度大的氯气从短管进入向下扩散,这样能较快的充分的混合,具体操作为将比空气轻的氨气从长管口f进入,比空气重的氯气从短管口g进入,使反应气体逆流接触充分反应,中间导管用于排出空气以减少内部压力,
故答案为:将比空气轻的氨气从长管口f进入,比空气重的氯气从短管口g进入,使反应气体逆流接触充分反应,中间导管用于排出空气以减少内部压力;
(3)装置A制取氨气,可用浓氨水与碱石灰(或烧碱或生石灰等),B装置中盛放的碱石灰,用来干燥氨气;G装置中盛放的饱和食盐水,用来除去氯气中混有的氯化氢气体;F装置用来干燥氯气,然后在E中混合反应,则连接顺序为a接d,e接f,g接h,i接j,k接b,
故答案为:a;d;e;h;i;j;k;b;除去C12中的HCl气体;
(4)氯气和氨气在常温下相混合就会发生反应生成氯化铵和氮气,反应的化学方程式为3C12+8NH3=6NH4Cl+N2,由化合价的变化可以看出,当3mol氯气参加反应时,有2mol氨气被氧化,所以氧化剂和还原剂的物质的量之比为3:2,
故答案为:3C12+8NH3=6NH4Cl+N2;3:2;
(5)氯气和氨气都污染空气,不能直接排放到空气中,实验缺少尾气处理装置,
故答案为:缺少尾气处理装置,造成空气污染.
点评:本题考查气体的制备和性质实验,题目难度中等,注意把握实验的原理和实验步骤,特别是实验仪器的连接顺序,为易错点.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目