题目内容
【题目】常温下,用0.1mol/L的NaOH溶液滴定相同浓度的一元弱酸HA20mL,滴定过程中溶液的pH随滴定分数(滴定分数= ![]() ) 的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
) 的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
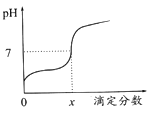
A. HA溶液加水稀释后,溶液中c(HA)/c(A-)的值减少
B. 当滴定分数为1时,溶液中水的电离程度最大
C. 当滴定分数大于1时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)> c(H+)
D. 当滴定分数为x时,HA的电离常数为KHA=(10-7x)/(1-x)
【答案】C
【解析】在弱酸HA溶液中存在电离平衡:HA![]() H++A—,加水稀释,平衡正向移动,c(HA)减小的倍数大于c(A—),稀释后,溶液中
H++A—,加水稀释,平衡正向移动,c(HA)减小的倍数大于c(A—),稀释后,溶液中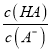 的值减小,A项正确;当滴定分数为1时,二者恰好完全反应,溶液中的溶质为NaA,属于强碱弱碱盐,促进水的电离,故当滴定分数为1时,溶液中水的电离程度最大,B项正确;当滴定分数大于1时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)> c(H+),也可能c(Na+)>c(OH-)>c(A-)> c(H+),C项错误;HA的电离常数K(HA)=
的值减小,A项正确;当滴定分数为1时,二者恰好完全反应,溶液中的溶质为NaA,属于强碱弱碱盐,促进水的电离,故当滴定分数为1时,溶液中水的电离程度最大,B项正确;当滴定分数大于1时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)> c(H+),也可能c(Na+)>c(OH-)>c(A-)> c(H+),C项错误;HA的电离常数K(HA)= 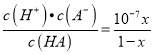 ,D项正确。
,D项正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】如下图所示的装置中,观察到电流计指针偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )
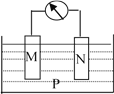
M | N | P | |
A | Zn | Cu | 稀硫酸溶液 |
B | Cu | Fe | 稀盐酸 |
C | Ag | Zn | 硝酸银溶液 |
D | Zn | Fe | 硫酸亚铁溶液 |
A. A B. B C. C D. D