题目内容
4.12mol/L盐酸的密度为1.19g/mL,现取12mol/L盐酸100mL,加多少毫升水才能配成密度为1.1g/mL的6mol/L的盐酸?分析 溶液稀释前后溶质的物质的量不变,则稀释前盐酸物质的量=12mol/L×0.1L=1.2mol,稀释后盐酸体积=$\frac{1.2mol}{6mol/L}$=0.2L,浓盐酸质量=1.19g/mL×100mL=119g,稀盐酸质量=1.1g/mL×200mL=220g,据此计算水体积.
解答 解:溶液稀释前后溶质的物质的量不变,则稀释前盐酸物质的量=12mol/L×0.1L=1.2mol,稀释后盐酸体积=$\frac{1.2mol}{6mol/L}$=0.2L,浓盐酸质量=1.19g/mL×100mL=119g,稀盐酸质量=1.1g/mL×200mL=220g,水体积=$\frac{220g-119g}{1g/mL}$=101mL,
答:加水体积是101mL.
点评 本题考查物质的量浓度计算,为高频考点,明确稀释前后溶质的物质的量不变是解本题关键,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
14.某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯.
已知: $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$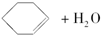

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止液体暴沸,②导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,分液后用c(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g(填g或f)口进入.蒸馏时要加入生石灰,目的是除去环己烯中少量的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c.
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出.
已知:
 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$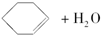

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止液体暴沸,②导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,分液后用c(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g(填g或f)口进入.蒸馏时要加入生石灰,目的是除去环己烯中少量的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c.
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出.
15.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用下列反应合成甲醇:
CO(g)+2H2(g)═CH3OH(g)△H
(1)化学平衡常数(K)的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
由表中数据判断△H<0 (填“>”、“=”或“<”).
(3)某温度下,将6mol CO和4.4mol H2充入2L的密闭容器中,10min该反应达到平衡,测得c(CO)=2.4mol•L-1,则用H2表示的10min内该反应的反应速率为0.12mol•L-1•min-1,此时的温度为300℃(从上表中选择),H2转化率=54.5%.
(4)判断该可逆反应达到化学平衡状态的标志是③④⑥(填序号).
①单位时间内,消耗2mol H2,同时生成1molCH3OH
②混合气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④CO、H2、CH3OH的浓度均不再变化
⑤CO、H2、CH3OH的分子数目比为1:2:1
⑥混合气体的总压强不再变化.
CO(g)+2H2(g)═CH3OH(g)△H
(1)化学平衡常数(K)的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.04 | 0.25 | 0.012 |
(3)某温度下,将6mol CO和4.4mol H2充入2L的密闭容器中,10min该反应达到平衡,测得c(CO)=2.4mol•L-1,则用H2表示的10min内该反应的反应速率为0.12mol•L-1•min-1,此时的温度为300℃(从上表中选择),H2转化率=54.5%.
(4)判断该可逆反应达到化学平衡状态的标志是③④⑥(填序号).
①单位时间内,消耗2mol H2,同时生成1molCH3OH
②混合气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④CO、H2、CH3OH的浓度均不再变化
⑤CO、H2、CH3OH的分子数目比为1:2:1
⑥混合气体的总压强不再变化.
12.下列说法中正确的是( )
| A. | 升高温度只能加快吸热反应速率 | |
| B. | 对于任何反应,增大压强都可加快反应速率 | |
| C. | 使用正催化剂只加快正反应速率 | |
| D. | 催化剂可以改变反应速率 |
19.下列溶液一定呈中性的是( )
| A. | 室温时将pH=5的盐酸稀释100倍所得到的溶液 | |
| B. | 等物质的量的强酸和强碱反应后所得到的混合溶液 | |
| C. | 氢氧化钠溶液与醋酸溶液混合后c(Na+)=c(CH3COO-)的溶液 | |
| D. | 硝酸铵溶于水得到的溶液 |
9.在恒容密闭容器中发生反应:H2(g)+I2(g)?2HI(g)(I2蒸气是紫色的),下列能表明反应已达到化学平衡状态的是( )
| A. | 容器内压强不再随时间变化 | |
| B. | 混合气体的颜色不再改变 | |
| C. | I2与H2在混合气体中的体积分数相等 | |
| D. | H2、I2、HI的浓度相等 |
13.在PH=1的透明溶液中可大量共存的是( )
| A. | Cu2+、SO42-、K+、Na+ | B. | Na+、Cl-、HSO3-、K+ | ||
| C. | MnSO4-、CO32-、Na+、K+ | D. | Fe3+、SO42-、S2-、Na+ |
14.下列事故处理方法正确的是( )
| A. | 实验室钠着火时,立即用水灭火 | |
| B. | 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 | |
| C. | 浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 | |
| D. | 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 |
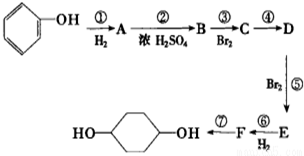 已知实验室由
已知实验室由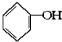 合成
合成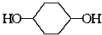 的反应流程如图(部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)请回答下列问题:
的反应流程如图(部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)请回答下列问题: 、D
、D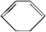 .
.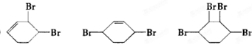 (其中一种).(写出一种即可)
(其中一种).(写出一种即可)