题目内容
10.已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是①⑤(填序号).①生成物的产量一定增加
②生成物的体积分数一定增加
③反应物的浓度一定降低
④反应物的转化率一定增加
⑤正反应速率一定大于逆反应速率.
分析 影响化学平衡移动的因素有浓度、温度、压强等,外界条件不同,对平衡移动的影响不同,改变条件使化学平衡向正反应方向移动,则正反应速率一定大于逆反应速率,生成物的产量一定增加.
解答 解:①平衡正向移动,生成物的产量一定增加,故正确;
②平衡向正反应方向移动,生成物的物质的量增大,但质量分数不一定增大如二氧化硫和氧气的反应,增大氧气的量很多时生成三氧化硫质量分数可能减小,故错误;
③增大反应物浓度,平衡移动的结果是减弱,而不是抵消,增大的反应物,达新平衡状态反应物的浓度比原来浓度大,所以反应物的浓度不一定降低,故错误;
④两种反应物的反应,增大一种物质的量,提高另一种物质的转化率,本身转化率减小,所以反应物的转化率不一定增大,故错误;
⑤平衡正向移动的实质是正反应速率一定大于逆反应速率,故正确;故答案为:①⑤.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
20.下列有关金属元素说法正确的是( )
| A. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作水的消毒剂 | |
| C. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 | |
| D. | 氯化铝是一种电解质,可用于电解法制铝 |
1.下列表示正确的是( )
| A. | HClO的结构式:H-O-Cl | B. | X=11,图表示钠原子的结构示意图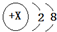 | ||
| C. | CCl4的电子式: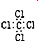 | D. | 乙炔的最简式:C2H2 |
18.生产、生活离不开化学.下列说法中不正确的是( )
| A. | 高纯硅是工业上制造光导纤维的主要原料 | |
| B. | 开发和推广新能源汽车是实现低碳生活的途径之一 | |
| C. | 寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法 | |
| D. | 不需要通过化学反应就能从海水中获得淡水 |
5.在含有Fe2+、Fe3+、Al3+、NH4+的溶液中加入足量的Na2O2固体,再加入过量的稀HCl,完全反应后,离子数目几乎没有改变的是( )
| A. | Fe2+ | B. | Fe3+ | C. | Al3+ | D. | NH4+ |
15.有关苯的结构和性质,下列说法正确的是( )
| A. |  与 与  是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 | |
| B. | 苯在空气中不易燃烧完全,燃烧时冒浓烟,说明苯组成中含碳量较高 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL溴的四氯化碳溶液,振荡后静置,可观察到液体分层,上层呈橙红色 |
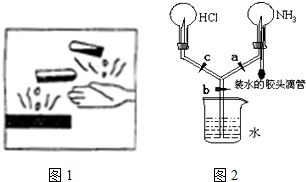
2.下列有关实验的描述正确的是( )
| A. | Fe(OH)3胶体的制备:将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液.继续煮沸至溶液呈红褐色,停止加热 | |
| B. | 乙酸乙酯的制备:在一支试管中加入3mL浓硫酸,然后慢慢加入2mL无水乙醇和2mL无水乙酸,加入几粒沸石用酒精灯小火加热 | |
| C. | 碳酸钠溶液的焰色反应:用铂丝直接蘸取碳酸钠溶液,在外焰上灼烧,观察火焰颜色 | |
| D. | 在纯锌与稀H2SO4反应中滴入少量的Cu(NO3)2溶液后生成H2的反应速率加快 |
19.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 相同温度下,测定某物质的量浓度的H2SO4溶液,H3PO4溶液的pH | pH(H2SO4)溶液<pH(H3PO4)溶液 | 非金属性S>P |
| B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有酸性、漂白性 |
| C | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+、NH3•H2O能大量共存 |
| D | 相同的铝片分别和同体积,同温度且c(H+)相等的盐酸,硫酸发生反应 | 为盐酸反应产生气体的速率快 | 酸性;盐酸>硫酸 |
| A. | A | B. | B | C. | C | D. | D |