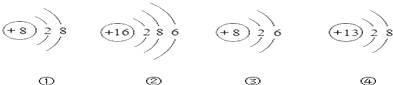
题目内容
【题目】某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成。称取天然碱样品四份溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如下表:
Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
样品(g) | 2.26 | 3.39 | 5.65 | 6.78 |
二氧化碳的体积(mL) | 448 | 672 | 784 | 672 |
(1)由以上数据,可以推测用1.13g样品进行同样的实验时,产生CO2______mL(标准状况).
(2)另取2.26g天然碱样品于300℃加热分解至完全(300℃时NaCO3不分解),产生CO2 112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式_________.
(3)依据上表所列数据以及天然碱的化学式,试求盐酸的浓度_________。
【答案】 224mL Na2CO3·NaHCO3·2H2O 2mol/L
【解析】本题考查化学计算,天然碱可看作是由CO2和NaOH反应生成,可能是Na2CO3,也可能是NaHCO3,也可能是Na2CO3和NaHCO3组成,根据表格数据,IV产生的CO2体积小于III中,说明天然碱不是NaHCO3,根据问题(2),Na2CO3在300℃时不分解,说明天然碱不是Na2CO3,从而推出天然碱是由Na2CO3和NaHCO3组成,(1)根据表格数据,随着样品质量增加,CO2体积增大,III之前存在样品质量与气体体积成正比,因此1.13g样品产生CO2的体积为448×1.13/2.26mL=224mL;(2)NaHCO3受热易分解,发生2NaHCO3 ![]() Na2CO3+CO2↑+H2O,n(NaHCO3)=2n(CO2)=2×112×10-3/22.4mol=0.01mol,产生水的物质的量为:n(H2O)=n(CO2)=112×10-3/22.4mol=0.005mol<0.45/18mol=0.025mol,说明天然碱中含有结晶水,即物质的量为(0.025-0.005)mol=0.02mol,根据碳元素守恒,n(Na2CO3)=(448×10-3/22.4-0.01)mol=0.01mol,n(Na2CO3):n(NaHCO3):n(H2O)=0.01:0.01:0.02=1:1:2,天然碱化学式为Na2CO3·NaHCO3·2H2O;(3)根据表格数据,IV组中盐酸完全反应,因为有气体产生,因此发生的反应是Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+CO2↑+H2O,消耗盐酸的物质的量为(672×10-3/22.4+6.78/226)mol=0.06mol,因此盐酸的浓度为0.06/30×10-3mol·L-1=2mol·L-1。
Na2CO3+CO2↑+H2O,n(NaHCO3)=2n(CO2)=2×112×10-3/22.4mol=0.01mol,产生水的物质的量为:n(H2O)=n(CO2)=112×10-3/22.4mol=0.005mol<0.45/18mol=0.025mol,说明天然碱中含有结晶水,即物质的量为(0.025-0.005)mol=0.02mol,根据碳元素守恒,n(Na2CO3)=(448×10-3/22.4-0.01)mol=0.01mol,n(Na2CO3):n(NaHCO3):n(H2O)=0.01:0.01:0.02=1:1:2,天然碱化学式为Na2CO3·NaHCO3·2H2O;(3)根据表格数据,IV组中盐酸完全反应,因为有气体产生,因此发生的反应是Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+CO2↑+H2O,消耗盐酸的物质的量为(672×10-3/22.4+6.78/226)mol=0.06mol,因此盐酸的浓度为0.06/30×10-3mol·L-1=2mol·L-1。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案