题目内容
【题目】氮及其化合物在工农业生产中具有重要作用。
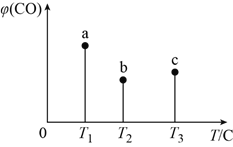
(1)某小组进行工业合成氨N2(g)+3H2(g)![]() 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。

实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为 。与实验①相比,.实验②所采用的实验条件可能为 (填字母),实验③所采用的实验条件可能为 (填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
a.升高温度 b.增大压强 c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到 (填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为 。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为 。
【答案】(12分)(1)0.012mol/(Lmin)(2分) e(1分) c(1分) (2)c(2分)
(3)HClO(1分) 67.5(2分) (4)>(1分) ![]() mol/L(2分)
mol/L(2分)
【解析】
试题分析:(1)根据图像可知,实验②中反应进行到10min到达平衡状态,平衡时氮气的物质的量浓度减少了=0.1mol/L-0.06mol/L=0.04mol/L。根据方程式可知,氢气的浓度变化量△c(H2)=3△c(N2)=3×0.04mol/L=0.12mol/L,所以υ(H2)=![]() =0.012mol/(Lmin);根据图像可知,与实验①相比,实验②到达平衡所用时间比较短,反应速率较快,但平衡时氮气的浓度不变,即改变条件平衡不移动。由于该反应正反应是气体体积减小的反应,故实验②的条件应是使用了催化剂,答案选e;根据图像可知,与实验①相比,实验③到达平衡所用时间也比较短,反应速率较快,但平衡时氮气的浓度增大,这说明改变体积平衡向逆反应移动。由于该反应正反应是体积减小的放热反应,因此实验③所采用的实验条件是升高温度,答案选c。
=0.012mol/(Lmin);根据图像可知,与实验①相比,实验②到达平衡所用时间比较短,反应速率较快,但平衡时氮气的浓度不变,即改变条件平衡不移动。由于该反应正反应是气体体积减小的反应,故实验②的条件应是使用了催化剂,答案选e;根据图像可知,与实验①相比,实验③到达平衡所用时间也比较短,反应速率较快,但平衡时氮气的浓度增大,这说明改变体积平衡向逆反应移动。由于该反应正反应是体积减小的放热反应,因此实验③所采用的实验条件是升高温度,答案选c。
(2)提高废气中氮氧化物的转化率,应改变条件使平衡向正反应移动,则:
a.该反应正反应是放热反应,升高温度,平衡向逆反应移动,氮氧化物的转化率降低,故a错误;
b.该反应正反应是体积增大的反应,增大压强,平衡向逆反应移动,氮氧化物的转化率降低,故b错误;c.增大NH3的浓度,平衡向正反应移动,氮氧化物的转化率增大,故c正确,答案选c。
(3)NCl3遇水发生水解反应生成NH3,这说明NCl3分子中负价原子结合水电离的H+,因此正价原子结合水电离的OH-,所以生成NH3的同时还得到HClO;反应中只有氯元素的化合价发生变化,氯元 素由NCl3中+1降低为Cl-中-1价,得到电子;由ClO2-中+3价升高为ClO2中+4价,失去1个电子,即每生成1molClO2,反应中就转移1mol电子。所以当转移1mol电子时,生成ClO2的物质的量为1mol,质量为1mol×67.5g/mol=67.5g。
(4)溶液显中性,所以c(H+)=c(OH-)。根据溶液的电荷守恒可得:c(H+)+c(NH4+)=c(Cl-)+ c(OH-),因此c(NH4+)=c(Cl-)。氯化铵是强酸弱碱盐,NH4+水解,其水溶液呈酸性,因此要使氯化铵溶液呈中性,则氨水应稍微过量。因为盐酸和氨水的体积相等,则氨水的物质的量浓度大于盐酸,即a>b;溶液中c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=0.5bmol/L,所以c(NH3H2O)=0.5amol/L-0.5bmol/L。电离常数只与温度有关,则此时NH3H2O的电离常数Kb=![]() =
=![]() mol/L.。
mol/L.。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 50mL 1 mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中c(OH-) /c(HCO3-) 增大 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D