题目内容
【题目】氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________。
(2)资料显示:![]()
![]()
![]() 。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
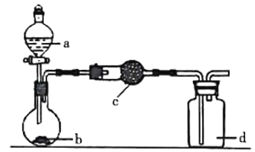
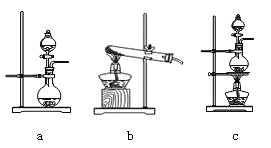
![]() 在该实验中,甲部分的装置是_______
在该实验中,甲部分的装置是_______![]() 填字母
填字母![]() 。
。
![]() 乙装置中
乙装置中![]() 溶液与
溶液与![]() 反应的离子方程式是________________。
反应的离子方程式是________________。
![]() 已知酸性:
已知酸性:![]() ,丙装置中通入少量
,丙装置中通入少量![]() ,可制得具有漂白、消毒的物质,这种物质是_______
,可制得具有漂白、消毒的物质,这种物质是_______![]() 化学式
化学式![]() 。
。
![]() 有人认为该实验存在明显的缺陷,如何改进:______________,请你写出Cl2和“
有人认为该实验存在明显的缺陷,如何改进:______________,请你写出Cl2和“![]() ”中“最合适的化学试剂”反应的离子方程式_________________________。
”中“最合适的化学试剂”反应的离子方程式_________________________。
(3)家庭中常用消毒液![]() 主要成分
主要成分![]() 与洁厕灵
与洁厕灵![]() 主要成分盐酸
主要成分盐酸![]() 清洁卫生。某品牌消毒液包装上说明如下图。
清洁卫生。某品牌消毒液包装上说明如下图。

![]() “与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:__________。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:__________。
![]() 漂粉精
漂粉精![]() 主要成分
主要成分![]() 与消毒液有相同的消毒功效,也需“密封保存”,请用化学方程式解释漂粉精因保存不当而变质失效的原因_________。
与消毒液有相同的消毒功效,也需“密封保存”,请用化学方程式解释漂粉精因保存不当而变质失效的原因_________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O c
MnCl2+Cl2↑+2H2O c ![]()
![]()
![]() 增加尾气处理装置
增加尾气处理装置 ![]()
![]() Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO
Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】
(1)实验室用二氧化锰和浓盐酸在加热条件下制取氯气。
(2) ![]() 用反应
用反应![]()
![]()
![]() 制取氯气,应选择固体和液体在加热条件下反应的装置。
制取氯气,应选择固体和液体在加热条件下反应的装置。
![]() 乙装置中
乙装置中![]() 溶液与
溶液与![]() 反应生成FeCl3。
反应生成FeCl3。
![]() 碳酸钠溶液中通入少量
碳酸钠溶液中通入少量![]() ,制得的具有漂白、消毒的物质是NaClO。
,制得的具有漂白、消毒的物质是NaClO。
![]() 氯气有毒,不经处理就排放会造成环境污染,该实验没有尾气处理装置,应该用NaOH溶液吸收过量的氯气。
氯气有毒,不经处理就排放会造成环境污染,该实验没有尾气处理装置,应该用NaOH溶液吸收过量的氯气。
(3) ![]() NaClO与盐酸反应会生成氯气,发生了氯气和水反应的逆反应。
NaClO与盐酸反应会生成氯气,发生了氯气和水反应的逆反应。
![]() 漂粉精的有效成分
漂粉精的有效成分![]() 能与二氧化碳和水生成次氯酸,次氯酸不稳定,见光分解,所以应该密封保存。据此写出发生反应的化学方程式。
能与二氧化碳和水生成次氯酸,次氯酸不稳定,见光分解,所以应该密封保存。据此写出发生反应的化学方程式。
![]() 浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯化锰、氯气、水,反应化学方程式为 MnO2+4HCl(浓)
浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯化锰、氯气、水,反应化学方程式为 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
![]() 甲中发生反应:
甲中发生反应:![]()
![]()
![]() ,根据该反应知,反应物是固液混合的,反应条件是加热,应选择装置c;
,根据该反应知,反应物是固液混合的,反应条件是加热,应选择装置c;
故答案为:c;
![]() 氯气具有强氧化性,与氯化亚铁反应生成氯化铁,反应离子方程式为:
氯气具有强氧化性,与氯化亚铁反应生成氯化铁,反应离子方程式为:![]()
![]() ;
;
故答案为:![]()
![]() ;
;
![]() 氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,由于酸性:
氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,由于酸性:![]() ,所以次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以化学方程式为:
,所以次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以化学方程式为:![]() ,具有漂白、消毒的物质是NaClO;
,具有漂白、消毒的物质是NaClO;
故答案为:NaClO;
![]() 氯气是有毒气体,所以不能直接排放到空气中,故应在丙装置后连接一个盛有NaOH溶液的洗气瓶防止氯气污染空气,改进措施为增加尾气处理装置;氯气与氢氧化钠溶液反应的离子方程式为
氯气是有毒气体,所以不能直接排放到空气中,故应在丙装置后连接一个盛有NaOH溶液的洗气瓶防止氯气污染空气,改进措施为增加尾气处理装置;氯气与氢氧化钠溶液反应的离子方程式为![]() ;
;
故答案为:![]() ;
;
![]() 次氯酸根离子与氯离子在酸性条件下发生氧化还原反应生成氯气和水,离子方程式为:
次氯酸根离子与氯离子在酸性条件下发生氧化还原反应生成氯气和水,离子方程式为:![]() ;
;
故答案为:![]() ;
;
![]() 漂粉精的有效成分
漂粉精的有效成分![]() 能与二氧化碳和水生成次氯酸,次氯酸不稳定,见光分解,所以应该密封保存。化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO
能与二氧化碳和水生成次氯酸,次氯酸不稳定,见光分解,所以应该密封保存。化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO![]() 2HCl+O2↑。
2HCl+O2↑。

 开心练习课课练与单元检测系列答案
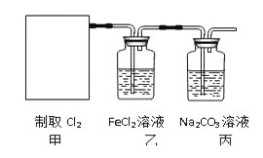
开心练习课课练与单元检测系列答案【题目】实验室中某些气体的制取、干燥及收集装置如图所示(省略夹持装置和尾气处理装置),仅用此装置和表中提供的物质完成相关实验,合理的是( )
选项 | a中物质 | b中物质 | c中干燥剂 | d收集气体 |
|
A | 浓硫酸 | 亚硫酸钠 | 无水氯化钙 | SO2 | |
B | 稀硫酸 | 大理石 | 无水氯化钙 | CO2 | |
C | 稀硝酸 | 铜片 | 碱石灰 | NO | |
D | 浓氨水 | 熟石灰 | 碱石灰 | NH3 |
A.AB.BC.CD.D